
【题目】已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。其实验流程如下图所示:
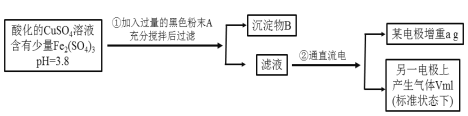
试回答下列问题:
(1)加入A的作用是___________________________。
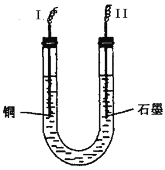
(2)步骤②中所用部分仪器如图所示:II电极上发生的电极反应式为___________________。
(3)步骤②的变化中,实现的能量转化形式是______________________。
(4)在进行测定铜的相对原子质量的实验操作中,属于不必要操作的是________。
a.称量电解前电极的质量
b.电解后电极在烘干前,必须用蒸馏水冲洗
c.小心刮下电解后电极上的铜,并清洗、称量
d.电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重,至少进行两次
e.在空气中烘干电极,必须采用低温烘干法
(5)铜的相对原子质量的计算式为________。
(6)假若电解后溶液呈无色,向其中滴加甲基橙试液,观察到的现象是_______________。
【答案】与H+反应,调节溶液的pH在4~5之间使Fe3+完全水解 4OH—4e-=2H2O+O2↑ 电能转化为化学能和热能 c ![]() 溶液变为红色
溶液变为红色
【解析】
该实验的目的是拟用电解CuSO4溶液的方法测定铜的相对原子质量;步骤①中加入的黑色粉末是CuO,以调节溶液pH至4~5,使Fe3+形成沉淀,从而获得纯净的CuSO4溶液;步骤②电解CuSO4溶液,阴极产生Cu而增重,阳极产生O2和H+,根据O2的体积可以得知产生Cu的物质的量,再根据阴极增加的质量计算得出Cu的摩尔质量,即Cu相对原子质量。
(1)该实验的目的是拟用电解CuSO4溶液的方法测定铜的相对原子质量,实验原料为pH=3.8的CuSO4和Fe2(SO4)3混合溶液,题中也告知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解,故步骤①中加入的黑色粉末是CuO,其目的是与H+反应,调节溶液的pH在4~5之间使Fe3+完全水解;
(2)步骤②中,阴极上Cu2+放电,产生Cu使得阴极增重,故I电极为阴极,II电极为阳极,阳极的电极反应为:4OH--4e-=2H2O+O2↑;
(3)步骤②中的能量转化形式为电能转化为化学能;
(4)a、阴极增重a g,是利用差量法计算而来,是称量电解前后的电极质量再作差,这样可以减小误差;
b、电解后电极在烘干前,必须用蒸馏水冲洗,洗掉电极表面附着的CuSO4等物质;
c、该实验中,用差量法来获得电极增加的质量,不需要将铜刮下;
d、电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重,至少进行两次,以确保充分烘干;
e、在空气中烘干电极,必须采用低温烘干法,避免Cu被氧化,影响实验结果;
综上所述,仅c不必要;
(5)根据电子转移守恒可知:2Cu-4e--O2,n(O2)=![]() =
= ![]() ,则n(Cu)=2n(O2)=
,则n(Cu)=2n(O2)=![]() ,m(Cu)=a g,则M(Cu)=
,m(Cu)=a g,则M(Cu)=![]() =
=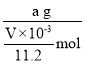 =
=![]() ;
;
(6)假若电解后溶液呈无色,说明溶液中只剩有H2SO4,加入甲基橙之后,溶液变为红色。


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设某元素原子核内的质子数为m,中子数为n,则下列论述正确的是( )
A.不能由此确定该元素的原子量
B.这种元素的原子量为(m+n)
C.若碳原子的质量为w g,此原子的质量为(m+n)w g
D.核内中子的总质量小于质子的总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
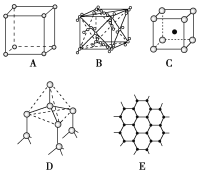
请回答下列问题:
(1)代表金刚石的是________(填编号字母,下同),其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
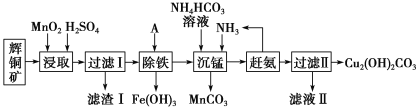
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,RSO4(s)+CO32-(aq)RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A.25℃ 时,RSO4的Ksp约为4.9×10-5
B.将浓度均为6×10-5mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH﹣![]() 2CO32﹣+6H2O,则有关说法正确的是 ( )
2CO32﹣+6H2O,则有关说法正确的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com