
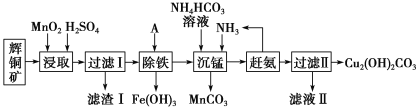
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
【答案】SiO2 2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O 3.7~5.6 4.0×10-11 Mn2++HCO3-+NH3=MnCO3↓+NH4+ (NH4)2SO4
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
(1)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2;
(2) “除铁”主要是除去溶液中Fe3+,根据题干表格可知,若要使Fe3+完全沉淀而不沉淀Cu2+,溶液的pH范围为:3.7~5.6或3.7≤pH<5.6;若溶液pH=5,即c(H+)=1×10-5mol/L,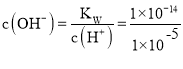 mol/L=1×10-9mol/L,c(Fe3+)=
mol/L=1×10-9mol/L,c(Fe3+)= 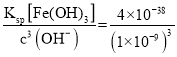 mol/L=4.0×10-11mol/L;
mol/L=4.0×10-11mol/L;
(3)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(4)根据分析,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液,滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+3Y(g)![]() 2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
A.10min时,容器内的压强是反应前的0.9倍
B.10min 时,X 的转化率为80%
C.10min内,用Y表示的平均反应速率为0.03 mol·L-1·s-1
D.前5分钟内,X 和Y 反应放出的热量等于0.1a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
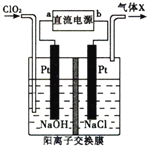
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。其实验流程如下图所示:
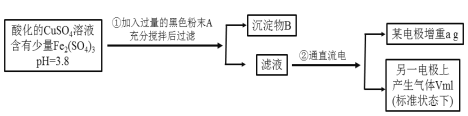
试回答下列问题:
(1)加入A的作用是___________________________。
(2)步骤②中所用部分仪器如图所示:II电极上发生的电极反应式为___________________。
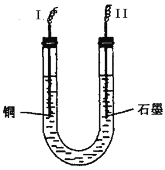
(3)步骤②的变化中,实现的能量转化形式是______________________。
(4)在进行测定铜的相对原子质量的实验操作中,属于不必要操作的是________。
a.称量电解前电极的质量
b.电解后电极在烘干前,必须用蒸馏水冲洗
c.小心刮下电解后电极上的铜,并清洗、称量
d.电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重,至少进行两次
e.在空气中烘干电极,必须采用低温烘干法
(5)铜的相对原子质量的计算式为________。
(6)假若电解后溶液呈无色,向其中滴加甲基橙试液,观察到的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol/L NaHSO4溶液中,阳离子数目之和为0.2NA
B.标准状况下0.2 mol Cl2溶于水中,转移的电子数为0.2NA
C.常温常压下1.5 g NO与1.6 g O2充分反应后混合物中原子总数为0.2NA
D.标准状况下,4.48 L HF含有的分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(![]() )为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为
)为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为![]() ;
;![]() ;
;![]() ;
;![]() 。
。
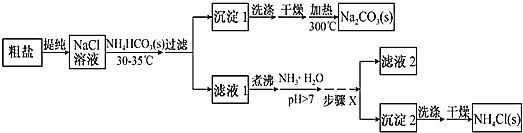
(1)粗盐中主要含有![]() 、
、![]() 、
、![]() 等杂质离子,粗盐提纯时使用的试剂有;①
等杂质离子,粗盐提纯时使用的试剂有;①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() ,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
A.①③④② B.①②④③ C.③②④① D.①②③④
(2)如何运用简单的方法判断粗盐中![]() 是否已除尽?__________。
是否已除尽?__________。
(3)从![]() 溶液到沉淀1的过程中,需蒸发浓缩。在加入固体
溶液到沉淀1的过程中,需蒸发浓缩。在加入固体![]() 之前进行蒸发浓缩优于在加入
之前进行蒸发浓缩优于在加入![]() 之后,原因是___________。
之后,原因是___________。
(4)写出沉淀1受热分解的化学方程式:_________。
(5)为提高![]() 产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
(6)某同学拟通过实验来测定该纯碱的纯度(假设杂质只含有![]() ),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的
),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的![]() 溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中
溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中![]() 的质量分数为____________。(用相关字母表示)
的质量分数为____________。(用相关字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中,NH3·H2O电离达到平衡的标志是( )
A.溶液显电中性B.溶液中检测不出NH3·H2O分子的存在
C.c(OH-)恒定不变D.c(![]() )=c(OH-)
)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com