
【题目】在氨水中,NH3·H2O电离达到平衡的标志是( )
A.溶液显电中性B.溶液中检测不出NH3·H2O分子的存在
C.c(OH-)恒定不变D.c(![]() )=c(OH-)
)=c(OH-)
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
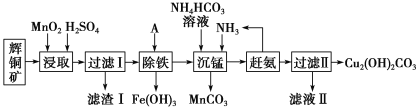
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一个一定容积的密闭容器中放入3 mol X和2 mol Y,发生反应:X(g)+Y(g)![]() 2Z(g)+R(g),达平衡时X的转化率为φ1。维持温度不变,若把6 mol X和3 mol Y放入该容器中,达平衡时X的转化率为φ2,则φ1与φ2的关系是( )
2Z(g)+R(g),达平衡时X的转化率为φ1。维持温度不变,若把6 mol X和3 mol Y放入该容器中,达平衡时X的转化率为φ2,则φ1与φ2的关系是( )
A.φ1>φ2B.φ1<φ2C.φ1=φ2D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的AlCl3溶液和NaOH溶液混合充分反应后,沉淀中所含的铝元素的物质的量和溶液中所含铝元素的物质的量相等。则氯化铝溶液和氢氧化钠溶液的物质的量浓度之比为 ( )
A.2:3B.2:5C.2:1D.2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由:__。
Ⅱ.请用文字叙述和离子方程式说明钡餐透视时为什么不用BaCO3?__。
Ⅲ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水 ②20mL0.5mol·L-1的Na2SO4溶液 ③40mL0.2mol·L-1的Ba(OH)2溶液 ④40mL0.1mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是__,BaSO4的溶解度的大小顺序为__(填序号)。
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为__,溶液②中c(Ba2+)为__。
(3)某同学取同样的溶液③和溶液④直接混合,则混合溶液的pH为__(假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
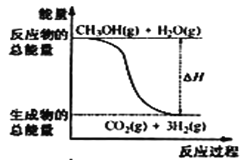
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )
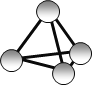
A.N4属于一种新型的化合物B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高D.1mo1N4气体转变为N2将放出882kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com