
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )
A.N4属于一种新型的化合物B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高D.1mo1N4气体转变为N2将放出882kJ热量
【答案】D
【解析】
A.N4由N组成,是一种单质,而化合物是由不同元素组成的纯净物,故A错误;
B.N4与N2是由N元素组成的两种不同单质,再者互为同素异形体,故B错误;
C.N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故C错误;
D.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167kJ=1002kJ,形成化学键放出的热量为2×942kJ=1884kJ,所以反应放热,放出的热量为1884kJ-1002kJ=882kJ,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】在氨水中,NH3·H2O电离达到平衡的标志是( )
A.溶液显电中性B.溶液中检测不出NH3·H2O分子的存在
C.c(OH-)恒定不变D.c(![]() )=c(OH-)
)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学反应方程式:
反应Ⅰ:N2H4(g)![]() N2(g)+2H2(g) ΔH1
N2(g)+2H2(g) ΔH1
反应Ⅱ:N2(g)+3H2(g)![]() 2NH3(g) ΔH2
2NH3(g) ΔH2
(1)ΔH1__ΔH2(填“<”、“>”或“=”)。
(2)7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可能是自发进行的吸热反应的是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
B.(NH4)2CO3(s)=NH4HCO3(g)+NH3(g)
C.2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)
D.2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在800K时,反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在国际环境问题中,一次性使用的聚苯乙烯材料的“白色污染”甚为突出,这种材料难以分解,处理麻烦。最近研制出了一种新型的材料![]() 能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
A.聚乳酸是一种纯净物
B.其聚合方式与聚苯乙烯相似
C.其单体为![]()
D.聚乳酸是一种线性高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COCH3![]() (CH3)3COMgBr
(CH3)3COMgBr![]() (CH3)3COH
(CH3)3COH![]() (CH3)3CMgBr
(CH3)3CMgBr![]() A
A![]() B
B![]() C + D
C + D
C![]() E D
E D![]() F + G
F + G
以丙酮等常见有机物为原料,由上述反应能合成醇B,B能消去1分子水得到三种烯烃C、D、H,其中占C80%,D占20%,H因含量极低而未列出,C的臭氧化物E不能发生银镜,D的臭氧化物F能发生银镜,其中1gF最多可得金属银14.4g,G与Cl2在光照下反应时,可得三种酮的一氯取代物。
(1).写出下列物质的结构简式:
A________________ B_________________ E_______________ G_______________
(2).用一个方程式表示B转化为C、D的反应。_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学进行实验探究FeCl3溶液和Na2S溶液的反应原理。
Ⅰ.学习小组的同学通过查阅以下资料和所学知识,预测产物。
资料:Fe2S3和FeS均为黑色、不溶于水、能溶于酸的固体,Fe2S3固体常温下易转变为黄绿色;H2S为有臭鸡蛋气味的气体。0.1mol/LNa2S溶液的pH约为12.9。
Ksp近似数据:Fe(OH)3为10-39,Fe2S3为10-88,FeS为10-19。
(1)同学甲计算出0.1mol/L的FeCl3溶液的pH约为__,依据酸碱理论的相关知识预测FeCl3与Na2S可能发生水解反应,则该反应的离子方程式为___。
(2)同学乙依据难溶电解质的溶解平衡理论的相关知识预测反应主要产生Fe2S3而不是Fe(OH)3的原因为__。
(3)同学丙依据氧化还原反应理论的相关知识预测FeCl3溶液与Na2S溶液反应可生成FeS和S的混合物,则反应的离子方程式为__。
Ⅱ.学习小组进行实验,探究反应生成沉淀物的成分。
实验一:

(4)某同学设计实验证明试管①中黑色物质含有Fe2S3,该同学的实验操作为_____。
(5)另一同学将试管②中黑色沉淀过滤洗涤后溶解于稀硫酸获得淡黄色悬浊液并闻到臭鸡蛋气味,判断沉淀为FeS和S的混合物,但有同学认为此判断不合理,请说明理由:__。
实验二:

(6)若试管③中沉淀溶解现象是因为溶液酸性较强将产生的少量黑色沉淀溶解,用离子方程式表示溶液酸性较强的原因:__。
(7)FeCl3溶液和Na2S溶液间可发生复分解反应也可发生氧化还原反应,且反应的产物、实验的现象与__等有关(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol;
②CO的燃烧热为283.0 kJ/mol。
则2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=________kJ/mol。
(2)在恒温、恒容条件下,将2.0 mol NO和1.0 mol CO充入一个容积为2 L的密闭容器中发生上述反应,反应过程中部分物质的物质的量(n)变化如图所示。
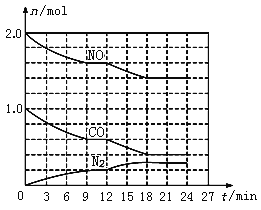
①N2在0~9 min内的平均反应速率v(N2)=________mol/(Lmin);
②第9 min时氮气的产率为________;
③第12 min时改变的反应条件可能为_______(填字母代号);
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
④若在第24min将NO与N2的浓度同时增加到原来的2倍,化学平衡______移动(填“向正反应方向”、“逆反应方向”或“不”)。
(3)若将反应容器改为恒温容积可变的恒压密闭容器,压强为P=3.0MPa,反应物加入的物质的量不变,达到平衡时CO的转化率为50%,该温度下此反应平衡常数Kp=______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com