
【题目】某学习小组同学进行实验探究FeCl3溶液和Na2S溶液的反应原理。
Ⅰ.学习小组的同学通过查阅以下资料和所学知识,预测产物。
资料:Fe2S3和FeS均为黑色、不溶于水、能溶于酸的固体,Fe2S3固体常温下易转变为黄绿色;H2S为有臭鸡蛋气味的气体。0.1mol/LNa2S溶液的pH约为12.9。
Ksp近似数据:Fe(OH)3为10-39,Fe2S3为10-88,FeS为10-19。
(1)同学甲计算出0.1mol/L的FeCl3溶液的pH约为__,依据酸碱理论的相关知识预测FeCl3与Na2S可能发生水解反应,则该反应的离子方程式为___。
(2)同学乙依据难溶电解质的溶解平衡理论的相关知识预测反应主要产生Fe2S3而不是Fe(OH)3的原因为__。
(3)同学丙依据氧化还原反应理论的相关知识预测FeCl3溶液与Na2S溶液反应可生成FeS和S的混合物,则反应的离子方程式为__。
Ⅱ.学习小组进行实验,探究反应生成沉淀物的成分。
实验一:

(4)某同学设计实验证明试管①中黑色物质含有Fe2S3,该同学的实验操作为_____。
(5)另一同学将试管②中黑色沉淀过滤洗涤后溶解于稀硫酸获得淡黄色悬浊液并闻到臭鸡蛋气味,判断沉淀为FeS和S的混合物,但有同学认为此判断不合理,请说明理由:__。
实验二:

(6)若试管③中沉淀溶解现象是因为溶液酸性较强将产生的少量黑色沉淀溶解,用离子方程式表示溶液酸性较强的原因:__。
(7)FeCl3溶液和Na2S溶液间可发生复分解反应也可发生氧化还原反应,且反应的产物、实验的现象与__等有关(写出一条即可)。
【答案】1.3 2Fe3++6H2O+3S2=2Fe(OH)3↓+3H2S↑ 由溶度积数据知,Fe2S3的溶解度远小于Fe(OH)3,则Fe3+更容易生成Fe2S3沉淀 2Fe3++3S2=2FeS↓+S↓ 过滤、洗涤,将滤渣放置一段时间,看是否全部或部分变为黄绿色 Fe2S3也溶于稀硫酸,溶解后所得Fe3+和S2,发生反应2H++S2 = H2S↑,2 Fe3++S2 = 2Fe2++S↓,也会产生预期现象 Fe3++3H2O3H++Fe(OH)3 试剂的滴加顺序和多少(试剂的相对用量)、反应体系的酸碱性
【解析】
I.(1)已知:①H2OH++OH,②Fe(OH)3(s)Fe3++3OH,由①×3②可得:Fe3++3H2O3H++Fe(OH)3(s),再结合Kw和Ksp进行计算溶液的pH值;Fe3+水解使溶液显酸性,而S2水解溶液显碱性,两者在同一溶液中相互促进水解生成Fe(OH)3和H2S,结合电荷守恒和原子守恒写出发生双水解反应的离子方程式。
(2)已知Fe(OH)3=1039,Fe2S3=1088,难溶物的溶解度越小越易生成。
(3)Fe3+有较强氧化性,而S2有较强还原性,两者在同一溶液中易发生氧化还原反应生成Fe2+和S,结合电子守恒、电荷守恒和原子守恒写出发生氧化还原反应的离子方程式;
II.(4)先分离出黑色固体,再根据Fe2S3和FeS均为黑色、不溶于水、能够溶于酸的固体,Fe2S3固体常温下易转变为黄绿色判断。
(5) Fe2S3固体能溶于稀硫酸,生成H2S气体和Fe3+,而Fe3+能与S2发生氧化还原反应生成淡黄色S沉淀。
(6)Fe3+在溶液中水解,使溶液明显显酸性。
(7)实验一表明在Na2S溶液中逐滴加入FeCl3溶液,主要发生的是复分解反应,实验二表明在FeCl3溶液中逐滴加入Na2S溶液主要发生的是氧化还原反应,由此分析即可。
I.(1)已知:①H2OH++OH,②Fe(OH)3(s) Fe3++3OH,由①×3②可得:Fe3++3H2O3H++Fe(OH)3(s),则c3(H+)÷c(Fe3+)=(Kw)3÷Ksp[Fe(OH)3],c3(H+)=(1×1014)3÷1×1039×0.1=104,c(H+)≈101.3mol/L,此时溶液pH=lg101.3=1.3;溶液FeCl3溶液与Na2S溶液混合,发生双水解反应生成Fe(OH)3和H2S,离子反应方程式为2Fe3++6H2O+3S2=2Fe(OH)3↓+3H2S↑;故答案为:1.3;2Fe3++6H2O+3S2=2Fe(OH)3↓+3H2S↑。
(2)已知Ksp近似数据:Fe(OH)3=1039,Fe2S3=1088,可知Fe2S3的溶解度远小于Fe(OH)3,则Fe3+更容易生成Fe2S3沉淀;故答案为:由溶度积数据知,Fe2S3的溶解度远小于Fe(OH)3,则Fe3+更容易生成Fe2S3沉淀。
(3)Fe3+有较强氧化性,而S2有较强还原性,依据氧化还原反应理论的相关知识预测FeCl3溶液与Na2S溶液反应可生成FeS和S的混合物,则发生反应的离子方程式为2Fe3++3S2=2FeS↓+S↓;故答案为:2Fe3++3S2=2FeS↓+S↓。
II.(4)为证明试管①中黑色物质含有Fe2S3,可经过过滤、洗涤,将滤渣放置一段时间,看是否全部或部分变为黄绿色,若为黄绿色,则固体为Fe2S3;故答案为:过滤、洗涤,将滤渣放置一段时间,看是否全部或部分变为黄绿色。
(5)将试管②中黑色沉淀过滤洗涤后溶解于稀硫酸获得淡黄色悬浊液并闻到臭鸡蛋气味,因Fe2S3也溶于稀硫酸,溶解后所得Fe3+和S2,发生反应2H++S2 = H2S↑,2 Fe3++S2 = 2Fe2++S↓,也会产生预淡黄色悬浊液并闻到臭鸡蛋气味的现象,则无法判断沉淀为FeS和S的混合物;故答案为:Fe2S3也溶于稀硫酸,溶解后所得Fe3+和S2,发生反应2H++S2 = H2S↑,2 Fe3++S2 = 2Fe2++S↓,也会生预期现象。
(6)试管③为在FeCl3溶液中逐滴加入Na2S溶液,最初发生复分解反应生成了黑色沉淀为Fe2S3,因过量的Fe3+在溶液中水解,使溶液明显显酸性,则振荡过程中Fe2S3沉淀被酸性溶液溶解并有臭鸡蛋气味的H2S气体生成,其中发生水解反应的离子方程式为Fe3++3H2O3H++Fe(OH)3;故答案为:Fe3++3H2O3H++Fe(OH)3。
(7)实验一表明在Na2S溶液中逐滴加入FeCl3溶液,主要发生的是复分解反应,实验二表明在FeCl3溶液中逐滴加入Na2S溶液主要发生的是氧化还原反应,由此可知FeCl3溶液和Na2S溶液间可发生复分解反应也可发生氧化还原反应,且反应的产物、实验的现象与试剂的滴加顺序和多少(试剂的相对用量)、反应体系的酸碱性等有关;故答案为:试剂的滴加顺序和多少(试剂的相对用量)、反应体系的酸碱性。


科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
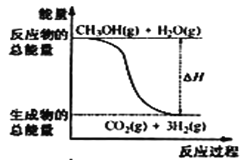
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )
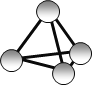
A.N4属于一种新型的化合物B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高D.1mo1N4气体转变为N2将放出882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
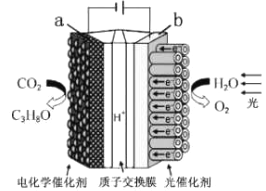
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
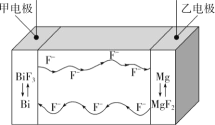
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。

(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物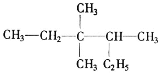 的名称为__。
的名称为__。
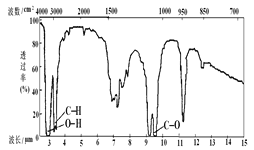
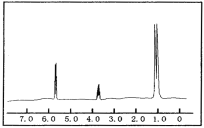
(2)已知某有机物的分子式为C3H8O,红外光谱和核磁共振氢谱如图,氢谱三个峰的面积之比分别为1∶1∶6,写出其结构简式___。
(3)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①烃A的分子式为__。
②若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__。
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为___,___。(任写2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.AlCl3溶液和Al2(SO4)3溶液蒸干、灼烧后所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在H2SO4溶液中,然后再用水稀释到所需的浓度
C.用热碱液可以去油污
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com