
【题目】下列反应可能是自发进行的吸热反应的是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
B.(NH4)2CO3(s)=NH4HCO3(g)+NH3(g)
C.2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)
D.2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
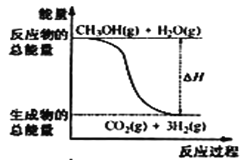
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—PakJ·mol-1、P—ObkJ·mol-1、P=OckJ·mol-1、O=OdkJ·mol-1。根据图示的分子结构和有关数据计算该反应的反应热______。
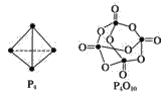
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如图:
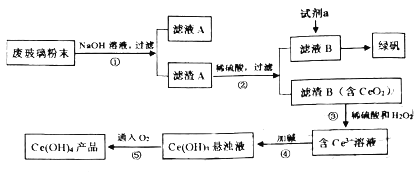
(1)写出第①步反应的离子方程式__。滤液A中的用途是___。
(2)向滤液B中加入过量试剂a可用于制备绿矾(FeSO4·7H2O),试剂a是__(填物质名称)充分反应后,经过滤得到FeSO4溶液。再经蒸发浓缩、冷却结晶、过滤、洗涤等操作步骤得到绿矾。检验所加试剂a已经过量,使用的试剂和判断的依据分别是__、__。
(3)写出第③步反应的化学方程式__。
(4)取上述流程中得到的Ce(OH)4[摩尔质量为208g·mol-1产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定(铈被还原为Ce3+)消耗20.00mL标准溶液,该产品中Ce(OH)4的质量分数为__(保留四位有效数字数)。若FeSO4标准溶液部分变质,会使测定结果__。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补血剂。实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁。有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物,相对分子质量为75 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶乙醇 |
Ⅰ.配制FeSO4溶液
用绿矾(FeSO4·7H2O)配制100mL1.00mol·L-1的FeSO4溶液。
(1)除托盘天平、药匙、烧杯、玻璃棒、量筒外,还需要的仪器有__。
Ⅱ.制备FeCO3
将配制好的绿矾溶液倒入烧杯中,缓慢加入200mL1.10mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
(2)反应的离子方程式为__。
Ⅲ.制备(NH2CH2COO)2Fe
制备装置如图所示(夹持和加热仪器已省略)。将Ⅱ中制备得到的FeCO3转移到装置D的三颈烧瓶中,检查气密性后,按如图所示加入足量的相关试剂,按以下操作进行实验。
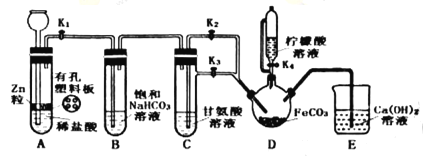
(3)关闭K2、打开K1、K3,此操作的目的是__;
(4)当观察到装置E中出现浑浊后,关闭K3、打开K2,此时可观察到的现象是__;
(5)关闭K1、K2、K3,打开K4,向三颈烧瓶中加入柠檬酸溶液,加热,使反应发生。加入柠檬酸溶液的目的除了调节溶液的pH促进FeCO3溶解,另一目的是__;
(6)反应结束后,将三颈烧瓶中所得到的混合物过滤,滤液经___(填操作)、过滤、洗涤、干燥得到产品。洗涤操作所选用的最佳洗涤试剂是__。
A.蒸馏水 B.乙醇 C.FeSO4溶液 D.柠檬酸溶液
Ⅳ.产率计算
(7)若得到的产品质量为17.96g,则产率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )
A.N4属于一种新型的化合物B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高D.1mo1N4气体转变为N2将放出882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
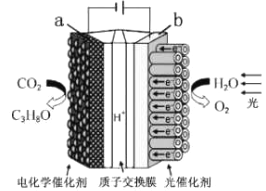
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com