
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补血剂。实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁。有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物,相对分子质量为75 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶乙醇 |
Ⅰ.配制FeSO4溶液
用绿矾(FeSO4·7H2O)配制100mL1.00mol·L-1的FeSO4溶液。
(1)除托盘天平、药匙、烧杯、玻璃棒、量筒外,还需要的仪器有__。
Ⅱ.制备FeCO3
将配制好的绿矾溶液倒入烧杯中,缓慢加入200mL1.10mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
(2)反应的离子方程式为__。
Ⅲ.制备(NH2CH2COO)2Fe
制备装置如图所示(夹持和加热仪器已省略)。将Ⅱ中制备得到的FeCO3转移到装置D的三颈烧瓶中,检查气密性后,按如图所示加入足量的相关试剂,按以下操作进行实验。
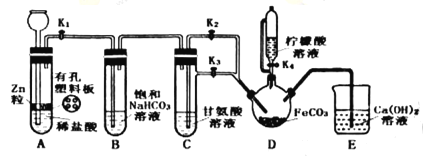
(3)关闭K2、打开K1、K3,此操作的目的是__;
(4)当观察到装置E中出现浑浊后,关闭K3、打开K2,此时可观察到的现象是__;
(5)关闭K1、K2、K3,打开K4,向三颈烧瓶中加入柠檬酸溶液,加热,使反应发生。加入柠檬酸溶液的目的除了调节溶液的pH促进FeCO3溶解,另一目的是__;
(6)反应结束后,将三颈烧瓶中所得到的混合物过滤,滤液经___(填操作)、过滤、洗涤、干燥得到产品。洗涤操作所选用的最佳洗涤试剂是__。
A.蒸馏水 B.乙醇 C.FeSO4溶液 D.柠檬酸溶液
Ⅳ.产率计算
(7)若得到的产品质量为17.96g,则产率为__。
【答案】100mL容量瓶、胶头滴管 Fe2++2HCO3-=FeCO3↓+CO2+H2O 用H2排除装置中的空气,防止氧气干扰实验 C中的溶液被压入D中 防止二价铁被氧化 蒸发浓缩,冷却结晶 D 88%
【解析】
根据配制一定物质的量浓度溶液的实验分析解答;根据题给信息及实验目的、装置分析解答;根据滴定原理计算产率。
(1)配制一定物质的量浓度的溶液还需要的仪器为 容量瓶和胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(2)根据题给信息知硫酸亚铁和NH4HCO3反应生成碳酸亚铁沉淀,则反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2+H2O,故答案为:Fe2++2HCO3-=FeCO3↓+CO2+H2O;
(3)根据实验装置分析,装置A作用是制取H2,实验过程中Fe2+易被空气中氧气氧化,所以可以用H2排出空气,故答案为:用H2排除装置中的空气,防止氧气干扰实验;
(4)D中澄清石灰水变浑浊,说明装置内空气排尽,关闭K3、打开K2,H2将C中的溶液被压入D中,故答案为:C中的溶液被压入D中;
(5)柠檬酸具有还原性,可以防止二价铁被氧化,故答案为:防止二价铁被氧化;
(6)由于甘氨酸亚铁易溶于水,且易被氧化,所以从滤液中分离出来的方法为蒸发浓缩,冷却结晶;由于甘氨酸亚铁易溶于水,难溶于乙醇,用乙醇洗涤产品可以减少产品的溶解,提高产率和纯度;故答案为:蒸发浓缩,冷却结晶;B;
(7)根据铁原子守恒知理论上产生的(NH2CH2COO)2Fe的物质的量为: n[(NH2CH2COO)2Fe]=n(FeCO3)=n(FeSO4)=0.1L×1.00mol·L-1=0.10mol,则产率为![]() ,故答案为:88%。
,故答案为:88%。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是____________________________________。
②试剂a是____________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。
(3)根据沉淀F的存在,推测![]() 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,![]() 被氧化为
被氧化为![]() 进入D。
进入D。
实验三:探究![]() 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。
②实验三的结论:__________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和![]() 生成。
生成。
(6)根据上述实验所得结论:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是重要的基础化工原料,下图是大学化学教材《有机化学基础》上由甲苯合成J的一种合成路线。
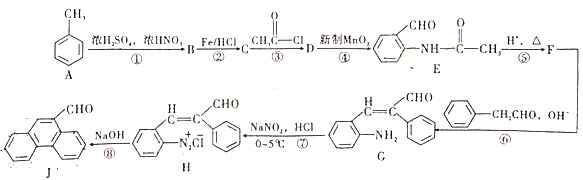
请依据上述流程回答以下问题
(1)B的化学名称为___________,J的分子式为___________。
(2)D生成E的反应类型为___________。
(3)设计第③步和第⑤步的目的是______________。
(4)由H生成J过程中生成的无机物除了![]() 外还有_________。
外还有_________。
(5)写出C→D的反应方程式为_______。
(6)D的同分异构体有多种。其中含有苯环和碳氧双键,且核磁共振氢谱有四组峰的有_________种。(不考虑立体异构)
(7)请依据流程图中相关信息,写出由甲苯和乙醛制备![]() 的合成路线________。(无机试剂任选)
的合成路线________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B. 4.0 mol SO2+1.0 mol O2
C. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可能是自发进行的吸热反应的是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
B.(NH4)2CO3(s)=NH4HCO3(g)+NH3(g)
C.2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)
D.2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式 2SO3(g)![]() 2SO2(g) + O2(g);△H1 = +197kJ/mol, 热化学方程式:2SO2(g) + O2(g)
2SO2(g) + O2(g);△H1 = +197kJ/mol, 热化学方程式:2SO2(g) + O2(g)![]() 2SO3(l);△H2 = — a kJ/mol 则下列说法正确的是( )
2SO3(l);△H2 = — a kJ/mol 则下列说法正确的是( )
A.a>197
B.a<197
C.a=197
D.热方程式中化学计量数可表示分子个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在国际环境问题中,一次性使用的聚苯乙烯材料的“白色污染”甚为突出,这种材料难以分解,处理麻烦。最近研制出了一种新型的材料![]() 能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
A.聚乳酸是一种纯净物
B.其聚合方式与聚苯乙烯相似
C.其单体为![]()
D.聚乳酸是一种线性高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是

A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是
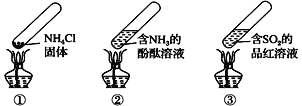
A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com