
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如图:
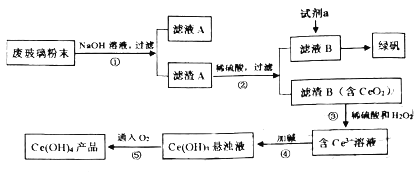
(1)写出第①步反应的离子方程式__。滤液A中的用途是___。
(2)向滤液B中加入过量试剂a可用于制备绿矾(FeSO4·7H2O),试剂a是__(填物质名称)充分反应后,经过滤得到FeSO4溶液。再经蒸发浓缩、冷却结晶、过滤、洗涤等操作步骤得到绿矾。检验所加试剂a已经过量,使用的试剂和判断的依据分别是__、__。
(3)写出第③步反应的化学方程式__。
(4)取上述流程中得到的Ce(OH)4[摩尔质量为208g·mol-1产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定(铈被还原为Ce3+)消耗20.00mL标准溶液,该产品中Ce(OH)4的质量分数为__(保留四位有效数字数)。若FeSO4标准溶液部分变质,会使测定结果__。(填“偏高”、“偏低”或“无影响”)
【答案】SiO2+2OH-=SiO32-+H2O 黏合剂、耐火阻燃材料、制备硅胶等 铁粉 KSCN溶液 溶液不变色 2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O 83.20% 偏高
【解析】
流程第①步反应废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2;滤渣A(Fe2O3、CeO2)加稀硫酸后过滤得滤液B是硫酸铁溶液,滤渣B的成分是CeO2;第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;第④步反应Ce3+加碱生成Ce(OH)3悬浊液;第⑤步反应Ce(OH)3悬浊液被氧化生成Ce(OH)4,据此分析解答。
(1)根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),可知能与氢氧化钠反应的是二氧化硅。其离子方程式为SiO2+2OH-=SiO32-+H2O,反应所得硅酸钠溶液作用有黏合剂、耐火阻燃材料、制备硅胶等,故答案为:SiO2+2OH-=SiO32-+H2O;黏合剂、耐火阻燃材料、制备硅胶等;
(2)滤液B是硫酸铁溶液,则试剂a为铁粉,若铁粉过量则溶液中没有Fe3+,检验Fe3+可以用KSCN溶液,若溶液不变色则说明没有Fe3+,说明试剂a已经过量,故答案为:铁粉;KSCN溶液;溶液不变色;
(3)第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,反应方程式为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)根据氧化还原反应中电子转移守恒知,n(Ce(OH)4)=n(FeSO4)= 0.1000mol·L-1×0.02L=0.002mol,则Ce(OH)4的质量分数为![]() ;若FeSO4标准溶液部分变质,则消耗的标准液偏多,会使测定结果偏高,故答案为:83.20%;偏高。
;若FeSO4标准溶液部分变质,则消耗的标准液偏多,会使测定结果偏高,故答案为:83.20%;偏高。


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含![]() 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
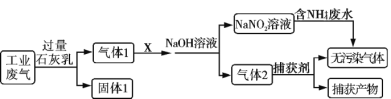
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X 可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含![]() 废水时,发生反应的离子方程式为:
废水时,发生反应的离子方程式为:![]() +
+![]()
![]() N2↑+2H2O
N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
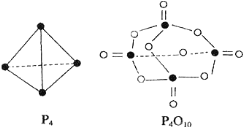
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学反应方程式:
反应Ⅰ:N2H4(g)![]() N2(g)+2H2(g) ΔH1
N2(g)+2H2(g) ΔH1
反应Ⅱ:N2(g)+3H2(g)![]() 2NH3(g) ΔH2
2NH3(g) ΔH2
(1)ΔH1__ΔH2(填“<”、“>”或“=”)。
(2)7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成高效、低毒农药杀灭菊酯(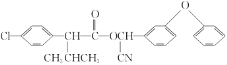 )流程如下:
)流程如下:
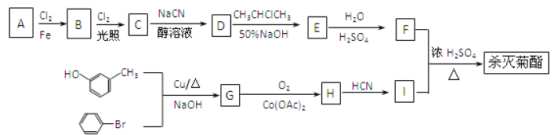
已知:
①R—X![]() RCN
RCN![]() RCOOH
RCOOH
②![]()
![]()
![]()
③![]()
![]()
![]()
④当苯环上连卤原子时,高温高压可以水解。
回答下列问题:
(1)按照系统命名法命名,B的名称是____;合成G的反应类型是________。
(2)有关A的下列说法正确的是________(填字母代号)。
a.A的所有原子可能处在同一平面上
b.A的核磁共振氢谱有5个峰
c.充分燃烧等质量的A和环己烷消耗氧气的量相等
d.A与苯互为同系物
e.A能使酸性KMnO4溶液褪色
(3)写出C在高温高压条件下与足量氢氧化钠水溶液充分反应的化学方程式:__________。
(4)写出反应F+I→杀灭菊酯的化学方程式:_______。
(5)H与银氨溶液水浴加热的离子方程式为:________。
(6)D在硫酸存在下发生水解生成J,符合下列要求的J的同分异构体有______种,并写出J的核磁共振氢谱为2: 2: 2: 1的所有结构简式:________。
①苯环上有两个取代基;②能水解成两种有机物;③可以发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可能是自发进行的吸热反应的是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
B.(NH4)2CO3(s)=NH4HCO3(g)+NH3(g)
C.2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)
D.2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在800K时,反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COCH3![]() (CH3)3COMgBr
(CH3)3COMgBr![]() (CH3)3COH
(CH3)3COH![]() (CH3)3CMgBr
(CH3)3CMgBr![]() A
A![]() B
B![]() C + D
C + D
C![]() E D
E D![]() F + G
F + G
以丙酮等常见有机物为原料,由上述反应能合成醇B,B能消去1分子水得到三种烯烃C、D、H,其中占C80%,D占20%,H因含量极低而未列出,C的臭氧化物E不能发生银镜,D的臭氧化物F能发生银镜,其中1gF最多可得金属银14.4g,G与Cl2在光照下反应时,可得三种酮的一氯取代物。
(1).写出下列物质的结构简式:
A________________ B_________________ E_______________ G_______________
(2).用一个方程式表示B转化为C、D的反应。_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质。它们之间的转化关系如图所示:
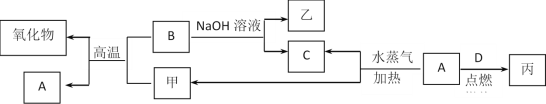
请回答下列问题:
(1)B与甲反应的化学方程式是___。
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?___(填“是”或“否”)。
(3)将丙溶于水配成溶液,检验丙中阳离子的方法所加试剂是:___。
(4)写出A与水蒸气反应生成C和甲的化学方程式___。
(5)向A、B两种金属的混合物中加入足量的NaOH溶液,发生反应的离子方程式为:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com