
【题目】已知反应X(g)+3Y(g)![]() 2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
A.10min时,容器内的压强是反应前的0.9倍
B.10min 时,X 的转化率为80%
C.10min内,用Y表示的平均反应速率为0.03 mol·L-1·s-1
D.前5分钟内,X 和Y 反应放出的热量等于0.1a kJ
【答案】A
【解析】
根据题意,该反应的三段式为:
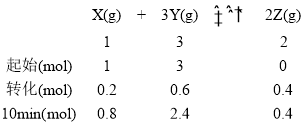
A、在恒温恒容的容器中,容器内总压强和体系的总物质的量呈正比,刚开始体系的总物质的量为4mol,10min时体系的总物质的量为3.6mol,则10min时,容器内的压强是反应前的0.9倍,A正确;
B、10min时,α(X)=![]() =20%,B错误;
=20%,B错误;
C、10min内,v(Y)=![]() = 0.03 mol·L-1·min-1,C错误;
= 0.03 mol·L-1·min-1,C错误;
D、反应物的浓度越大,反应速率也越大;10min时Y反应了0.6mol,则5min时,Y的转化量大于0.3mol,即X的转化量大于0.1mol,所以前5min内,X 和Y 反应放出的热量大于0.1a kJ,D错误;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路,下列叙述正确的是( )
后,使c、d两点短路,下列叙述正确的是( )

A. a为直流电源的负极
B. f电极为锌板
C. c极发生的反应为2H++2e-=H2↑
D. e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界中一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe![]() Sb4O6+6FeS,
Sb4O6+6FeS,
②Sb4O6+6C![]() 4Sb+6CO↑。关于反应①、②的说法正确的是
4Sb+6CO↑。关于反应①、②的说法正确的是
A.反应①、②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3molFeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 molSb时,反应①与反应②中还原剂的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下1 mol A和n mol B在一个容积可变的容器中发生如下反应:
A(g)![]() 2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
A.物质A、B的转化率之比一定是1∶2
B.若起始时放入3 mol A+3n mol B,则达平衡时生成3a mol C
C.起始时刻和达平衡后容器中的压强比为 (1+n)/(1+n-a/2)
D.当v正(A) =2v逆(C)时,可断定反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设某元素原子核内的质子数为m,中子数为n,则下列论述正确的是( )
A.不能由此确定该元素的原子量
B.这种元素的原子量为(m+n)
C.若碳原子的质量为w g,此原子的质量为(m+n)w g
D.核内中子的总质量小于质子的总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?)![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
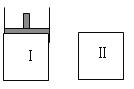
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
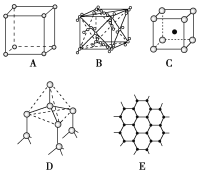
请回答下列问题:
(1)代表金刚石的是________(填编号字母,下同),其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
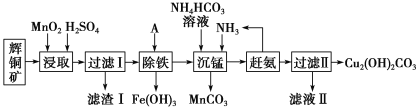
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一个一定容积的密闭容器中放入3 mol X和2 mol Y,发生反应:X(g)+Y(g)![]() 2Z(g)+R(g),达平衡时X的转化率为φ1。维持温度不变,若把6 mol X和3 mol Y放入该容器中,达平衡时X的转化率为φ2,则φ1与φ2的关系是( )
2Z(g)+R(g),达平衡时X的转化率为φ1。维持温度不变,若把6 mol X和3 mol Y放入该容器中,达平衡时X的转化率为φ2,则φ1与φ2的关系是( )
A.φ1>φ2B.φ1<φ2C.φ1=φ2D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com