
【题目】下列对各电解质溶液的分析不正确的是
A.硫酸氢钠溶液中:c(H+)=c(OH-)+c(SO42-)
B.向稀氨水中滴加稀盐酸至恰好中和:c(NH4+)<c(Cl-)
C.0.l mol·L-1 Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=c(Na+)
D.向CH3COONa溶液中加适量蒸馏水:c(CH3COO-)与c(OH-)都减小,c(OH-)/c(CH3COO-)增大
科目:高中化学 来源: 题型:
【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
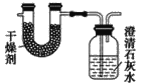
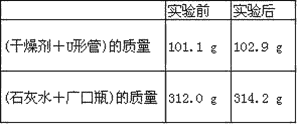
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为_____________g。
(2)生成的水中氢元素的质量为_______g。
(3)生成的二氧化碳中碳元素的质量为_______ g。
(4)该燃料中碳元素与氢元素的质量比为_______。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_______,结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用的部分流程,下列有关说法正确的是
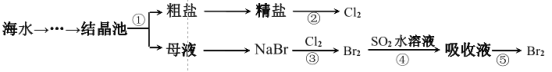
A.实验室进行步骤①需要坩埚、玻璃棒等仪器
B.步骤②是一个将化学能转化为电能的过程
C.步骤③、⑤涉及的化学反应均为氧化还原反应
D.步骤④中的离子方程式为 SO2+Br2+2H2O=4H++SO32-+2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
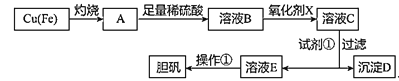
溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)溶液B中含有的阳离子有__(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__(填字母)。
A.NaClO B.H2O2 C.KMnO4
写出加入氧化剂X时,发生反应的离子方程式___。
(3)加入试剂①是为了调节pH,试剂①可以选择__(填化学式)。
已知:残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。则Fe(OH)3的溶度积常数Ksp=___。
(4)操作①的步骤:___、___、过滤、洗涤、干燥。
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是__。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.将FeCl3溶液滴加到淀粉-KI溶液中,溶液显蓝色
C.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液中出现红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.2H2(g)+O2(g)=2H2O(g) ΔH=+483.6kJ/mol
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.CO(g)的燃烧热△H=-283kJ/mol,则2CO2(g)=2CO(g)+O2(g)ΔH=+566kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中发生反应CO(g)+2H2(g)![]() CH3OH(g),CH3OH的物质的量与时间变化图像如图:
CH3OH(g),CH3OH的物质的量与时间变化图像如图:
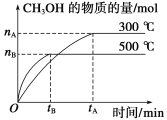
(1)该反应的平衡常数表达式K=__;
(2)降低温度,K值将__(填“增大”、“减小”或“不变”)。
(3)若起始时加入1molCO和2molH2,则达平衡时,CO和H2的转化率之比为__。
(4)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__(用nB,tB表示)。
(5)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.CO的浓度不再变化
b.混合气体的密度不再改变
c.混合气体的平均摩尔质量不再改变
d.v生成(CH3OH)=v消耗(CO)
(6)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是__。
,在其他条件不变的情况下,对平衡体系产生的影响是__。
a.CH3OH的物质的量增加
b.正反应速率加快,逆反应速率减慢
c.c(CO)和c(H2)均减小
d.重新平衡时![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com