
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
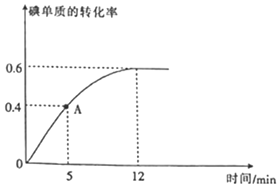
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
【答案】![]()
![]()
![]()
![]() 9
9 ![]() AD
AD ![]()
【解析】
(1)![]() ,
,![]() ,
,![]()
![]() ,根据盖斯定律
,根据盖斯定律![]() 计算
计算![]() 的焓变
的焓变![]() ;
;
(2)由图可知,A点时反应正向进行,碘单质的转化率为![]() ,则
,则![]() ,根据
,根据![]() 计算
计算![]() ,结合反应的速率之比等于计量数之比求出
,结合反应的速率之比等于计量数之比求出![]() ;
;
(3)根据反应三段式计算达到平衡状态时氢气的物质的量,将平衡分压代入![]() 表达式
表达式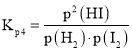 中计算
中计算![]() ;由于反应
;由于反应![]() ,即
,即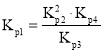 ,则
,则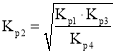 ;
;
(4)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(5)![]() 是一种强酸,一水合氨是弱碱,常温下将
是一种强酸,一水合氨是弱碱,常温下将![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等体积混合后,溶液呈中性,此时溶质为
的氨水等体积混合后,溶液呈中性,此时溶质为![]() 和氨水,根据电荷守恒
和氨水,根据电荷守恒![]() ,因为溶液呈中性,则
,因为溶液呈中性,则![]() ,所以
,所以![]() ,据此进行分析。
,据此进行分析。
(1)![]()
![]()
![]()
![]()
根据盖斯定律![]() 计算
计算![]() 的焓变
的焓变![]() ,即
,即![]() ,
,
故答案为:![]() ;
;
(2)由图可知,A点时反应正向进行,即![]() ;碘单质的转化率为
;碘单质的转化率为![]() ,则
,则![]() ,
,![]() ,由
,由![]() 可知
可知![]() ,
,
故答案为:![]() ;
;![]() ;
;
(3)反应三段式

则达到平衡状态时,氢气的物质的量分数![]() ;
;
平衡分压![]() 、
、![]() ,所以
,所以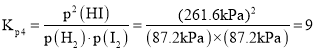 ;
;
由于反应![]() ,则
,则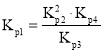 ,则
,则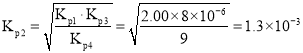 ,
,
故答案为:![]() ;9;
;9;![]() ;
;
(4)A.反应达平衡前,气体颜色在变,颜色不再变化,则说明反应达平衡,故A正确;
B.由于此反应的反应物和生成物均为气体,即体系中气体的总质量不变,而此反应前后气体的物质的量也不变,所以气体的平均相对分子质量始终不变,即不能说明反应体系达到平衡状态,故B错误;
C.由于反应物均为气体,且反应前后质量守恒,且容器为恒容的容器,所以气体密度始终不变,即气体密度不变不能说明反应是否达平衡,故C错误;
D.化学变化过程中伴随着能量的变化,所以温度不再变化说明反应体系达到平衡状态,故D正确,
故选:AD;
(5)![]() 是一种强酸,一水合氨是弱碱,常温下将
是一种强酸,一水合氨是弱碱,常温下将![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等体积混合后,溶液呈中性即
的氨水等体积混合后,溶液呈中性即![]() ,电荷守恒关系为
,电荷守恒关系为![]() ,则
,则![]() ,故以
,故以![]() ,
,
故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
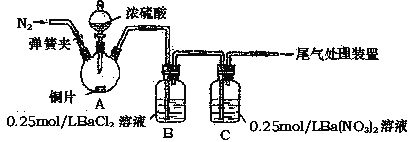
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | -------------------------------------------------- |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是__________________________________________。
(2)C中白色沉淀是_________,该沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上,甲同学在原有操作之前增加一步操作,该操作是_____________;乙同学在A、B间增加洗气瓶D,D中盛放的试剂是____________。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 是一种难熔稀有金属,我国的钼居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
是一种难熔稀有金属,我国的钼居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:![]()
![]()
![]() ,则
,则![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]()
(2)密闭容器中用![]() 作固硫剂,同时用一定量的氢气还原辉钼矿
作固硫剂,同时用一定量的氢气还原辉钼矿![]() 的原理是:
的原理是:![]() ,实验测得平衡时的有关变化曲线如图所示:
,实验测得平衡时的有关变化曲线如图所示:
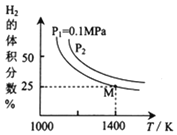
![]() 由图可知,该反应的
由图可知,该反应的![]() ______0
______0![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,
,![]() ______
______![]() MPa
MPa![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______
如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______![]() 选填编号
选填编号![]() 。
。
A.![]()
![]() 容器内气体的密度不变时,一定达平衡状态
容器内气体的密度不变时,一定达平衡状态
C.再加入![]() ,则
,则![]() 转化率增大
转化率增大![]() 容器内压强不变时,一定达平衡状态
容器内压强不变时,一定达平衡状态
(3)电氧化法提纯钼的原理:将辉钼矿![]() 放入装有食盐水的电解槽中,用惰性电极电解,
放入装有食盐水的电解槽中,用惰性电极电解,![]() 被氧化为
被氧化为![]() 和
和![]() 阴极的电极反应式为______。
阴极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
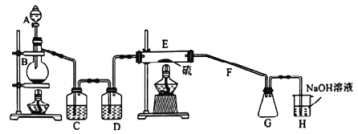
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K、1.01×105 Pa,将22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反应,测得反应放出的热量为a kJ。已知该条件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反应放出的热量为b kJ。则CO2与NaOH反应生成NaHCO3的热化学方程式为( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com