
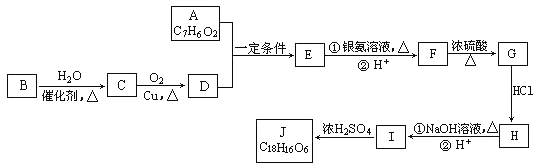
����Ŀ���л�������J���������ಡҩ���һ���м��壬���ӽṹ�к���3����Ԫ��������һ�ֺϳ�·�����£�
��֪��
��A���ܷ���������Ӧ��������FeCl3��Һ������ɫ��Ӧ����˴Ź���������ʾ��4���⣬�ҷ����֮��Ϊ1�U2�U2�U1��
���л���B��һ����Ҫ��ʯ�ͻ�����Ʒ��������������������ҵ�ʯ�ͻ�����չˮƽ��
��![]()
�ش��������⣺
��1��A�к��еĹ�����������_________________________________��
��2��д���л���Ӧ����B��C__________��F��G_________��I��J_________��
��3��д��F����G�Ļ�ѧ����ʽ____________________________________��
��4��д��J�Ľṹ��ʽ__________________________________��
��5��E��ͬ���칹���ж��֣�д�����з�������Ҫ���E��ͬ���칹��Ľṹ��ʽ_____________��
��FeCl3��Һ������ɫ��Ӧ ���ܷ���������Ӧ
�۱�����ֻ��������λȡ���� ���ܷ���ˮ�ⷴӦ��
���𰸡���1���ǻ�������ǻ�����ȩ�� ��2�֣�
��2���ӳɷ�Ӧ����ȥ��Ӧ��ȡ����Ӧ����������Ӧ����3�֣�
��3��![]() ��3�֣�
��3�֣�
��4��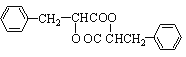 ��3�֣�
��3�֣�
��5��![]() ��4�֣�
��4�֣�
������������������л���B��һ����Ҫ��ʯ�ͻ�����Ʒ��������������������ҵ�ʯ�ͻ�����չˮƽ����B����ϩ����ˮ�����ӳɷ�Ӧ�����Ҵ�����C���Ҵ����Ҵ���������������D����D����ȩ��A���ܷ���������Ӧ��������FeCl3��Һ������ɫ��Ӧ��˵������ȩ���ͷ��ǻ�����˴Ź���������ʾ��4���⣬�ҷ����֮��Ϊ1�U2�U2�U1�������A�ķ���ʽ��֪A�Ľṹ��ʽΪ![]() ��������֪��Ϣ����֪A��D����ȩ���ļӳɷ�Ӧ����E����E�Ľṹ��ʽΪ
��������֪��Ϣ����֪A��D����ȩ���ļӳɷ�Ӧ����E����E�Ľṹ��ʽΪ![]() ��E����������Ӧ����F����F�Ľṹ��ʽΪ
��E����������Ӧ����F����F�Ľṹ��ʽΪ![]() .F��Ũ����������·�����ȥ��Ӧ����G����G�Ľṹ��ʽΪ
.F��Ũ����������·�����ȥ��Ӧ����G����G�Ľṹ��ʽΪ![]() ��G���Ȼ��ⷢ���ӳɷ�Ӧ����H��Hˮ������I��2����I����������Ӧ����J������J���ӽṹ�к���3����Ԫ������H��I��J�Ľṹ��ʽ�ֱ���
��G���Ȼ��ⷢ���ӳɷ�Ӧ����H��Hˮ������I��2����I����������Ӧ����J������J���ӽṹ�к���3����Ԫ������H��I��J�Ľṹ��ʽ�ֱ���![]() ��
��![]() ��
��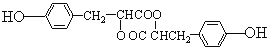 .��
.��
��1������A�Ľṹ��ʽ��֪A�к��еĹ������������ǻ�������ǻ�����ȩ����
��2���������Ϸ�����֪B��C��F��G��I��J�ķ�Ӧ���ͷֱ��Ǽӳɷ�Ӧ����ȥ��Ӧ��ȡ����Ӧ����������Ӧ����
��3��F����G�Ļ�ѧ����ʽΪ
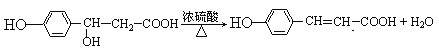 ��
��
��4���������Ϸ�����֪J�Ľṹ��ʽΪ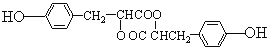 ��
��
��5��E��ͬ���칹���ж��֣�д�����з�������Ҫ���E��ͬ���칹��Ľṹ��ʽ��
FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ����ܷ���������Ӧ��˵������ȩ����������ֻ��������λȡ�������ܷ���ˮ�ⷴӦ��˵���Ǽ����γɵ�������������������л���ṹ��ʽΪ![]() ��
��![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ���Һ�������Ե���
A. NaHCO3 B. (NH4)2SO4 C. NaCl D. CH3COOK
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȱ���Ⱦ�ϡ�ҽҩ��ҵ���������챽�ӡ������ȱ��������������ӵ��л��м��塣ʵ�������Ʊ��ȱ���װ������ͼ��ʾ�����мг�����������װ����ȥ��
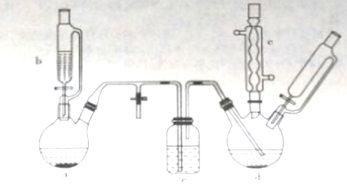
��ش��������⣺
(1)����a��ʢ��KMnO4���壬����b��ʢ��Ũ���ᡣ������b�еĻ�����ʹŨ���Ỻ�����£��ɹ۲쵽����a�ڵ�������__________�������ӷ���ʽ��ʾ�����������ԭ��_______________��
(2)����b��ಣ�����ܵ�������_____________��
(3)����d��ʢ�б���FeCl3��ĩ���壬����a�����ɵ����徭������e���뵽����d�С�
������e��������_________����ʢװ���Լ�������_____________��
������d�еķ�Ӧ���й����У������¶���40~60�棬�Լ��ٸ���Ӧ����������d�ļ��ȷ�ʽ�����___���ȣ����ŵ���____________��
(4)����c��������______________��
(5)�÷����Ʊ����ȱ��к��кܶ����ʣ���ҵ�����У�ͨ��ˮϴ��ȥFeCl3��HCl������Cl2��Ȼ��ͨ����ϴ��ȥCl2����ϴ��ͨ����Һ�õ����ȱ����л�����������ɷּ��е����±���
�л��� | �� | �ȱ� | �ڶ��ȱ� | ����ȱ� | �Զ��ȱ� |
�е�/�� | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
�Ӹ��л�����������ȡ�ȱ�ʱ����������ķ������ռ�_________�����õ���֡�
(6)ʵ�ʹ�ҵ�����У�������ʧ���±���
��ʧ��Ŀ | �����ӷ� | ���ȱ� | ���� | �ϼ� |
����ʧ����kg/t�� | 28.8 | 14.5 | 56.7 | 100 |
ijһ��Ͷ������13t�������Ƶ��ȱ�________t������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A2(g)+B2(g)![]() 2C3(g)����H=��Q1 kJ/mol(Q1>0)�� ��һ���д������ݻ�������ܱ������м���2 molA2��1 molB2����500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw mol��L��1���ų�����ΪQ2 kJ��
2C3(g)����H=��Q1 kJ/mol(Q1>0)�� ��һ���д������ݻ�������ܱ������м���2 molA2��1 molB2����500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw mol��L��1���ų�����ΪQ2 kJ��
��1������ƽ��ʱ�� A2��ת����Ϊ ��
��2���ﵽƽ�������ԭ������ͨ�������������A2��ת���ʽ� (���������С�����䡱)
��3������ԭ���������У�ֻ����2mol C3��500��ʱ��ַ�Ӧ��ƽ�����������Q3 kJ��C3Ũ�� (��>��=��<)w mol��L��1��Q1��Q2��Q3 ֮��������ֹ�ϵ��Q3= ��
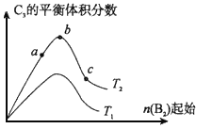
��4���ı�ijһ�������õ���ͼ�ı仯����(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)���ɵó��Ľ�����ȷ���� ��
a����Ӧ����c��b��a
b���ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a��c
c��T2��T1
d��b��A2��B2�����ʵ���֮��Ϊ2��1
��5����������������Ϊ��ѹ����������ʼʱ����4 molA2��2 molB2��500��ʱ��ַ�Ӧ��ƽ��ų�����Q4 kJ����Q2 Q4(����>������<������=��)��
��6�����д�ʩ����ͬʱ��߷�Ӧ���ʺ�B2��ת������ (��ѡ�����)��
a��ѡ���ʵ��Ĵ��� b������ѹǿ
c����ʱ�������ɵ�C3 d�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ͼ��ʾ���ʵ��ת����
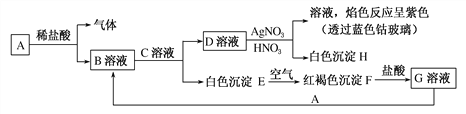
����д���пհף�
(1)д���������ʵĻ�ѧʽ��A________��C________��
(2)B�н��������ӵļ��鷽��Ϊ___________________________________________��
(3)D����H�����ӷ���ʽΪ____________________________________��
(4)д����Eת���F�Ļ�ѧ����ʽ��_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������;�㷺��������ָʾ���ʹ����Ʊ���һ������ˮ�ܿ����Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��MgO��CaO�ȣ���ȡCoC2O4��2H2O�����������£�

��֪��������Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
������������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1�����������м���Na2SO3��Ŀ���ǽ�_____________��ԭ�������ӷ��ţ��Ա�����ܽ⡣�ò���Ӧ�����ӷ���ʽΪ ��дһ������
��2��NaClO3�������ǽ�����Һ�е�Fe2+������Fe3+����Ԫ�ر���ԭΪ��ͼۡ��÷�Ӧ�����ӷ���ʽΪ ��
��3������ƽ���ƶ�ԭ����������Na2CO3��ʹ����Һ��Fe3+��Al3+ת�����������������ԭ���� ��
��4����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ����Һ���м�����ȡ���������� ��ʹ����ȡ�����˵�pH=____������ţ����ң�
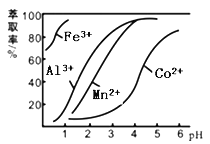
A��2.0 B��3.0 C�� 4.0
��5����Һ�����ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp(MgF2)��7.35��10-11��Ksp(CaF2)��1.05��10-10�����������NaF��������Һc(Mg2+)/c(Ca2+)�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ú�ͺ��������Һ ��42�����Ҵ���Һ ���Ȼ��ƺ͵��ʵ��ˮ��Һ���������ϸ����Һ����ȷ����������
A����Һ����ȡ������ B����ȡ������Һ
C����Һ��������ȡ D��������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪HCN(aq)��NaOH(aq)��Ӧ����1 mol���ε���H����12.1 kJ/mol��ǿ�ᡢǿ���ϡ��Һ��Ӧ���к�����H����57.3 kJ��mol��1����HCN��ˮ��Һ����������H���ڣ� ��
A. ��69.4 kJ��mol��1 B. ��45.2 kJ��mol��1
C. ��69.4 kJ��mol��1 D. ��45.2 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������д�������ƽ�⣺CO(g)+H2O(g)![]() CO2(g)+H2(g)��CO2��ƽ��Ũ��c(CO2)���¶�T�Ĺ�ϵ��ͼ��ʾ��
CO2(g)+H2(g)��CO2��ƽ��Ũ��c(CO2)���¶�T�Ĺ�ϵ��ͼ��ʾ��

����˵������������ ��
A����ӦCO(g)+H2O(g)![]() CO2(g)+H2(g)�� ��H��0
CO2(g)+H2(g)�� ��H��0
B����T2ʱ������Ӧ����״̬D����һ���Ц�(��)����(��)
C��ƽ��״̬A��C��ȣ�ƽ��״̬A��c(CO)��
D����T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com