
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:
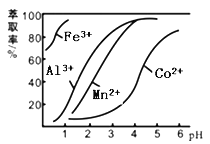
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。
【答案】(1)(4分)Fe3+、Co3+(2分)
SO32-+2Fe3++H2O=SO42-+ 2Fe2++2H+或SO32-+2 Co3++H2O=SO42-+ 2Co2++2H+(2分)
(2)(3分)ClO3-+6Fe2+ +6H+=6Fe3++Cl- +3H2O
(3)(3分)因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O![]() M(OH)3+3H+(1分),加入碳酸钠后CO32-与H+结合生成难电离的HCO3-(1分),使水解平衡右移而产生沉淀(1分)[或:CO32-可发生水解CO32-+H2O
M(OH)3+3H+(1分),加入碳酸钠后CO32-与H+结合生成难电离的HCO3-(1分),使水解平衡右移而产生沉淀(1分)[或:CO32-可发生水解CO32-+H2O![]() HCO3-+OH-,而因Fe3+和Al3+也发生水解:M3++H2O
HCO3-+OH-,而因Fe3+和Al3+也发生水解:M3++H2O![]() (OH)3+3H+,从而形成双水解使平衡右移,金属离子生成沉淀。其它正确叙述相应给分]
(OH)3+3H+,从而形成双水解使平衡右移,金属离子生成沉淀。其它正确叙述相应给分]
(4)(2分)除去Mn2+(1分) B(1分)[pH=3时,Co2+溶解最少,其它离子溶解较多]
(5)(2分)0.7[Ksp(MgF2)÷Ksp(CaF2)=7.35×10-11÷1.05×10-10=0.7]
【解析】试题分析:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴。
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,反应的离子方程式为SO32-+2Fe3++H2O=SO42-+ 2Fe2++2H+或SO32-+2 Co3++H2O
=SO42-+ 2Co2++2H+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2+ +6H+=6Fe3++Cl- +3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O![]() R(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀;
R(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)当加入过量NaF后,所得滤液中c(Mg2+) / c(Ca2+) =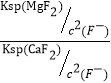 =
=![]() = 0.7。
= 0.7。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A. a点对应的无色溶液中能大量存在:Fe3+、Na+、Cl-、SO42-
B. b点对应的溶液中能大量存在:NH4+、Ca2+、AlO2-、I-
C. c点对应的溶液中能大量存在:Na+、Ba2+、Cl-、CO32-
D. d点对应的溶液中能大量存在:Na+、K+、SO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=__________KJ/mol。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式 。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为: (用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 。
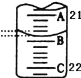
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为 mL。
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C= mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应4A(s)+3B(g)![]() 2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol/(Lmin)
B.2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
C.2 min末的反应速率用B表示是0.3 mol/(Lmin)
D.分别用B、C、D表示的反应速率其比值是3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:
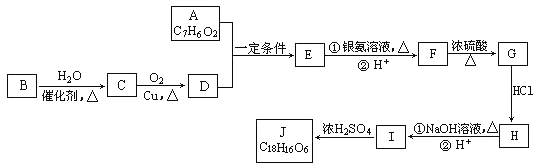
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,且峰面积之比为1︰2︰2︰1。
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③![]()
回答以下问题:
(1)A中含有的官能团名称是_________________________________。
(2)写出有机反应类型B→C__________,F→G_________,I→J_________。
(3)写出F生成G的化学方程式____________________________________。
(4)写出J的结构简式__________________________________。
(5)E的同分异构体有多种,写出所有符合以下要求的E的同分异构体的结构简式_____________。
①FeCl3溶液发生显色反应 ②能发生银镜反应
③苯环上只有两个对位取代基 ④能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为 ( )
A. 0.15 mol/L B. 0.10 mol/L C. 0.25 mol/L D. 0.20 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.2mol的铁与足量的稀硝酸反应,生成气体的分子效目为0.3NA
B. 常温常压下,14g由C2H4、C3H6组成的混合气体中含有碳原子的数目为NA
C. 2.24LCO2与足量的Na2O2反应.转移的电子总数必为0.1NA
D. 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/LNaOH溶液滴定20.00mL 0.10mol/LHA溶液(滴定曲线见图)。下列说法正确的是
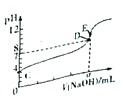
A. 此图可以表示从NaOH滴定盐酸的曲线
B. 图中D点状态时溶液中有:c(Na+)<c(A-)
C. 达到D、E状态时,均有:c(Na+)+c(H+)=c(A-)+c(OH-)
D. 当O<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)> c(Na+)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,不正确的是
A. 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应
B. 2,5一二甲基己烷的核磁共振氢谱中会出现三组峰
C. 糖类、油脂和蛋白质在一定条件下都能发生水解反应
D. 分子式为C5H12的有机物只有三种,它们属于同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com