
【题目】化合物M是一种光致抗蚀剂,可用于印刷电路和集成电路工艺中,其合成路线如下:
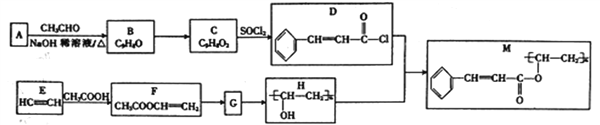
已知:I. 
II.羟基直接连接在碳碳双键的碳原子上的有机物是不稳定的。
回答下列问题:
(1)下列关于M的说法正确的是______(填字母)。
a.M属于高分子化合物
b.M在碱性溶液中能稳定存在
c.M能使酸性高锰酸钾溶液褪色
d.1molM与足量氢气反应时,最多消耗4molH2
(2)C中官能团的名称为______,由E生成F的反应类型为_________。
(3)F的化学名称为_______,由F生成G的化学方程式为____________。
(4)二取代芳香族化合物W(只含苯环,不含其他的环,且不含“C=C=C”结构)是D的同分异构体,W能与三氯化铁溶液发生显色反应,则W的结构共有____种(不含立体异构),其中核磁共振氢谱为五组峰的结构简式为____________。
(5)参照上述合成路线,设计一条以HC≡CH为原料(其他无机试剂任选)制备G的合成路线:________________________。
![]()
【答案】 ac 碳碳双键、羧基 加成反应 乙酸乙烯酯 ![]() 9
9 ![]()
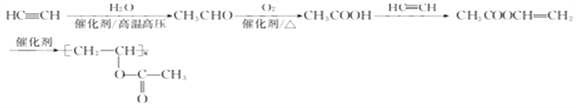
【解析】由信息I可知,A和乙醛反应生成B,分子中增加了7个C原子,再根据D中含有苯环,推出A为苯甲醛。由信息II可知,烃基直接连接在碳碳双键的碳原子上的有机物是不稳定的,推出F到G发生的加聚反应,而不是酯的水解反应,因为F水解后会生成一个不稳定的有机物乙烯醇,它会自动发生分子结构重排转化为乙醛,只有加聚反应之后再水解,才能转化为H聚乙烯醇。
(1).因为M是合成高分子,含有官能团碳碳双键和酯基,所以M能在碱性条件下发生水解反应、可以被酸性高锰酸钾氧化,1molM有n mol链节,与氢气发生加成反应时,每个链节能与4个氢气分子加成,所以1mol可与4n mol H2加成。所以选 ac
(2). C中官能团的名称为碳碳双键、羧基,由E生成F的反应类型为加成反应。 (3). F的化学名称为乙酸乙烯酯,由F生成G的化学方程式为:![]()
(4). W能与三氯化铁溶液发生显色反应,说明W含酚羟基。由于W是二取代芳香族化合物W,所以另一个侧链含有3个C原子、一个Cl原子且有两个不饱和度,不含“C=C=C”则只能含碳碳叁键(C—C≡C),这样的侧链有三种结构,每一种都与羟基有邻、间、对三种位置关系,所以则W的结构共有9种(不含立体异构),其中核磁共振氢谱为五组峰的结构简式为![]() 。
。
(5). 以HC≡CH为原料(其他无机试剂任选)制备G,首先利用最后一个信息将HC≡CH与水加成得到乙醛,然后将乙醛催化氧化得到乙酸,最后利用题中流程E到F到G的转化即可合成G,所以合成路线如下: 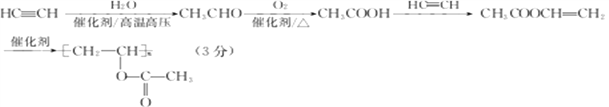


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32—、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
A.K+、OH-、CO32— B.Cu2+、H+、Cl- C.K+、H+、Cl- D.CO32—、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解化学方程式或水解离子方程式正确的是
A.CH3COO- +H2O![]() CH3COOH + OH-
CH3COOH + OH-
B.NH4++H2O![]() NH4OH + H+
NH4OH + H+
C.CH3COOH+NaOH![]() CH3COONa+H2O
CH3COONa+H2O
D.NaCl+H2O![]() NaOH+HCl
NaOH+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后分别与相同浓度的盐酸反应,都恰好完全反应时,若第一份用去盐酸V1mL,第二份用去盐酸V2mL,则两者的关系为( )
A. V1=V2 B. V1>V2 C. V1<V2 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 化学反应除了生成新的物质外,还伴随着能量的变化
B. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
C. 放热反应不需要加热就能发生
D. 吸热反应不加热就不会发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)![]() CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)![]() 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g)![]() CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律:
a)
b)

(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 C达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入 。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为 ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50mL12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)( )
A.一样多
B.后者较前者多
C.前者较后者多
D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A. 溶液中Ca2+数目增多 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com