
【题目】用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)![]() CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)![]() 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g)![]() CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律:
a)
b)

(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 C达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入 。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为 ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为 。
【答案】(1)4△H1+△H2+2△H3;
(2)a)、放热反应的lgK随温度升高而下降; b)、放出或吸收热量越大的反应,其lgK受温度影响越大;
(3)99%
(4)CO2
(5)CaS+2O2 ![]() CaSO4,
CaSO4,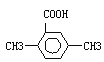
【解析】本题的解题要点:首先要理解盖斯定律的原理,如何运用盖斯定律;其次对图像的总结是开放性题目,看待问题的出发点不同,得到的结论可能不同,尽力与所学知识联系;转化率的计算不是本题的难点;从气体的类别上分析,运用平衡的观点解决(4)的问题;对于化学方程式的书写,注意题目所给信息,判断出反应物、产物,再结合质量守恒定律写出其他物质并配平即可。最后物质结构简式的判断需注意是否存在同分异构现象,分析苯环的等效氢的种类,写出其结构简式。
(1)根据盖斯定律可得2 CaSO4(s)+7CO(g)![]() CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;
(2)由图像及反应的△H可知,a)、反应①③是放热反应,随温度升高,lgK降低;反应②是吸热反应,随温度升高,lgK增大;b)、从图像上看出反应②、③的曲线较陡,说明放出或吸收热量越大的反应,其lgK受温度影响越大;
(3)由图可知,反应①于900 C的lgK=2,则K=100, c平衡(CO)=8.0×10-5mol·L-1,平衡时c平衡(CO2)=100×8.0×10-5mol·L-1=8.0×10-3mol·L-1,根据反应1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;
1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;
(4)根据方程式可知,二氧化碳中含有气体杂质SO2,可在CO中加入适量的CO2,抑制二氧化硫的产生;
(5)CaS转化为CaSO4,从元素守恒的角度分析,CaS与氧气发生化合反应,原子的利用率100%,生成CaSO4,化学方程式为CaS+2O2 ![]() CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为
CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为 。
。


科目:高中化学 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_____________;
(2)写出氮气分子的结构式____________。
Ⅱ.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
含有极性键和非极性键的是_______;
含有非极性键的离子化合物是_____。(填序号,下同)
Ⅲ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解;⑦碘升华;⑧溴蒸气被木炭吸附。
(1)未破坏化学键的是_____________;
(2)仅离子键被破坏的是_____________;
(3)仅共价键被破坏的是_____________。
Ⅳ.下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④14N、14C
(1)互为同位素的是:______;
(2)互为同素异形体的是:______;
氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对摩尔的叙述中不正确的是
A.摩尔是一个单位,用于计量物质所含微观粒子的数量
B.摩尔是一个物理量
C.1mol任何气体所含的气体分子数目都相等
D.摩尔既能用来计量纯净物,又能用来计量混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种光致抗蚀剂,可用于印刷电路和集成电路工艺中,其合成路线如下:
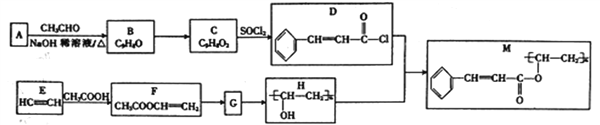
已知:I. 
II.羟基直接连接在碳碳双键的碳原子上的有机物是不稳定的。
回答下列问题:
(1)下列关于M的说法正确的是______(填字母)。
a.M属于高分子化合物
b.M在碱性溶液中能稳定存在
c.M能使酸性高锰酸钾溶液褪色
d.1molM与足量氢气反应时,最多消耗4molH2
(2)C中官能团的名称为______,由E生成F的反应类型为_________。
(3)F的化学名称为_______,由F生成G的化学方程式为____________。
(4)二取代芳香族化合物W(只含苯环,不含其他的环,且不含“C=C=C”结构)是D的同分异构体,W能与三氯化铁溶液发生显色反应,则W的结构共有____种(不含立体异构),其中核磁共振氢谱为五组峰的结构简式为____________。
(5)参照上述合成路线,设计一条以HC≡CH为原料(其他无机试剂任选)制备G的合成路线:________________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是 ( )
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
B. 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5 NA
C. 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA
D. C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物在材料领域一直扮演重要角色。下列叙述中,不正确的是( )
A. 石英可用来制作工艺品 B. 硅单质可以用来制造太阳能电池
C. 硅单质是制造玻璃的主要原料 D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z是短周期元素,aW3+、bX+、cY2﹣、dZ﹣四种离子具有相同的电子层结构,下列关系正确的是( )
A.最外层电子数:Y>Z
B.核电荷数:a>b
C.稳定性:H2Y>HZ
D.X单质一定能从W的盐溶液中置换出W单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com