
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程如下。
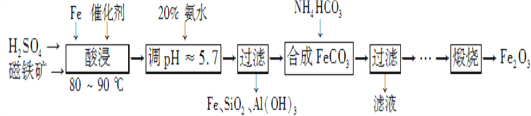
(1) 酸浸时,采用80-90℃的原因_______________________________________________;
铁粉的作用是____________________________________。
(2) 合成碳酸亚铁的离子方程式__________________________________________________________________。
(3) 图中“滤液”中主要阳离子是_______________________________________________________________;
(4)为了测定磁铁矿中铁的含量,称取80 g的磁铁矿样品加入足量稀硫酸使其充分溶解,过滤,得溶液100mL,取20mL溶液在酸性条件下用0.4 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
①写出滴定时反应的离子方程式__________________________________________
②当溶液中Fe2+ 全部被氧化时,c(Fe3+)=_____________________mol·L-1, (写出计算过程)。
【答案】 加快反应速率 将Fe3+还原为Fe2+(或作还原剂) Fe2+ +HCO3-=FeCO3+CO2+H2O NH4+ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H20 3mol/L
【解析】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程:酸浸过程中四氧化三铁和酸反应Fe3O4+4H2SO4![]() Fe2(SO4)3+FeSO4+4H2O生成亚铁离子、铁离子和水,氧化铝和酸反应:Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不反应,加入过量铁粉将Fe3+还原为Fe2+:Fe+2Fe3+=3Fe2+,因Ksp[Fe(OH)2]=8×10-16;Ksp[Al(OH)3]=1.3×10-33,所以加入20%的NH3H2O,调PH=5.7,Al3++3NH3H2O═Al(OH)3↓+3NH4+,过滤得到滤渣为:Fe、SiO2、Al(OH)3,滤液中含有Fe2+、NH4+,加入碳酸氢铵得到FeCO3,碳酸亚铁和氧气反应4FeCO3+O2
Fe2(SO4)3+FeSO4+4H2O生成亚铁离子、铁离子和水,氧化铝和酸反应:Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不反应,加入过量铁粉将Fe3+还原为Fe2+:Fe+2Fe3+=3Fe2+,因Ksp[Fe(OH)2]=8×10-16;Ksp[Al(OH)3]=1.3×10-33,所以加入20%的NH3H2O,调PH=5.7,Al3++3NH3H2O═Al(OH)3↓+3NH4+,过滤得到滤渣为:Fe、SiO2、Al(OH)3,滤液中含有Fe2+、NH4+,加入碳酸氢铵得到FeCO3,碳酸亚铁和氧气反应4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(1) 温度升高,反应速率加快,采用80-90℃温度酸浸是为了加快反应速率;加入过量铁粉将Fe3+还原为Fe2+:Fe+2Fe3+=3Fe2+,以便下一步进行铁、铝分离,;
(2) 碳酸氢铵和溶液里的Fe2+作用生成FeCO3,发生反应的离子方程式为Fe2+ +HCO3-=FeCO3+CO2+H2O ;
(3) 加入20%的NH3H2O,调PH=5.7,Al3++3NH3H2O═Al(OH)3↓+3NH4+,过滤得到滤渣为:Fe、SiO2、Al(OH)3,滤液中含有Fe2+、NH4+,加入碳酸氢铵得到FeCO3,此时图中滤液主要成分为NH4+;
(4) ①滴定时MnO4-在酸性条件氧化Fe2+,发生反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②Fe3O4中Fe2+与Fe3+的物质的量之比为1:2,消耗KMnO4的物质的量为0.4 mol·L-1 ×0.01L=0.004mol,则溶液中Fe2+ 全部被氧化时,c(Fe3+)=![]() mol·L-1=3mol/L。
mol·L-1=3mol/L。


科目:高中化学 来源: 题型:
【题目】将反应5IO3-+I-+6H+![]() 3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。
3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。

下列判断不正确的是
A. 开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B. 开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝。
C. 电流计读数为零时,反应达到化学平衡状态
D. 两次电流计指针偏转方向相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应的说法,正确的是( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.酸碱中和反应的逆反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是

A. 铜棒为正极,其电极反应式为2H++2e- = H2↑
B. 烧杯左侧碳棒为阴极,其电极表面有红色物质析出
C. 反应中消耗锌的质量为13 g
D. 导线中通过的电子的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. SO2使品红、酸性高锰酸钾溶液褪色,均体现SO2的漂白性
B. 完全由非金属元素组成的化合物不一定是共价化合物
C. 元素周期表有18列,就有18个族
D. SO2的水溶液能导电,所以SO2是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol SO42﹣的质量是96 g
B.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 g
D.HCl的相对分子质量是36.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是

A. 该电池工作时将电能转化为化学能
B. 通常一段时间后该电池只需更换铝板就可继续使用
C. 负极反应式是:O2 + 2H2O+ 4e- = 4OH-
D. 铝片发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境、健康及能源的叙述中,不正确的是
A. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含 量是空气质量报告的主要项目
B. PM2.5表面积大,能吸附大量的有毒有害的物质,对人的肺功能造成很大伤害
C. 聚乙烯是生产食品保鲜膜、塑料水杯等生活用品的主要材料,不能用聚氯乙烯替代
D. 利用催化转化装置可以将汽车尾气中的NOx、CO等有害气体转化为N2、CO2等无害气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com