
【题目】下列叙述正确的是( )
A.1mol SO42﹣的质量是96 g
B.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 g
D.HCl的相对分子质量是36.5 g/mol
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】写出下列化合物的名称或结构简式:
①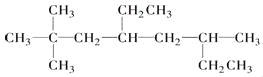 的名称为________________________.
的名称为________________________.
②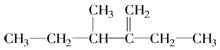 的名称为______________________________.
的名称为______________________________.
③2,5-二甲基-2,4-己二烯的结构简式:__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程如下。
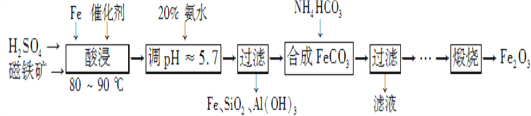
(1) 酸浸时,采用80-90℃的原因_______________________________________________;
铁粉的作用是____________________________________。
(2) 合成碳酸亚铁的离子方程式__________________________________________________________________。
(3) 图中“滤液”中主要阳离子是_______________________________________________________________;
(4)为了测定磁铁矿中铁的含量,称取80 g的磁铁矿样品加入足量稀硫酸使其充分溶解,过滤,得溶液100mL,取20mL溶液在酸性条件下用0.4 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
①写出滴定时反应的离子方程式__________________________________________
②当溶液中Fe2+ 全部被氧化时,c(Fe3+)=_____________________mol·L-1, (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式___________________。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
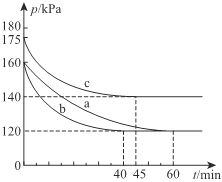
①与实验a相比,c组改变的实验条件可能是______________,判断的依据是______________________。
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为______________________。
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH=-42kJ·mol-1。
SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T2 | 0.20 | 0.30 | a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=__________,该温度下的平衡常数为______________。
②实验丙中,达到平衡时,NO2的转化率为_______________。
③由表中数据可推知,T1_____T2(填“>”“<”或“=”),判断的理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2![]() 2NH3(正反应是放热反应).下列有关说法正确的是
2NH3(正反应是放热反应).下列有关说法正确的是
A. 升高温度能加快反应速率
B. 1mol N2和3mol H2的总能量低于2mol NH3的总能量
C. 达到化学反应限度时,生成2molNH3
D. 平衡时各组分含量之比一定等于3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属元素性质的叙述中正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正化合价
C.金属元素在自然界中全部以化合态存在
D.金属元素的单质在常温下均为固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com