
【题目】根据电子排布的特点,原子序数为30的元素X在周期表中属于( )
A.s区
B.p区
C.d 区
D.ds区
科目:高中化学 来源: 题型:
【题目】 A、B两种有机物组成的混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧产生CO2的量均相等,符合这一组合的各件有:①同分异构体;②同系物;③具有相同的实验式;④含碳的质量分数相同,其中一定正确的是
A. ①③④
B. ②③
C. ①②③
D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol SO42﹣的质量是96 g
B.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 g
D.HCl的相对分子质量是36.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。

根据以上信息,回答下列问题:
⑴H的化学式为____________________________。
⑵ A的电子式___________________________________________。
⑶ G→J的离子方程式为________________________________________________________________。
⑷ M是含氧酸盐,化学式为Na2FeO4,则反应①的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是

A. 该电池工作时将电能转化为化学能
B. 通常一段时间后该电池只需更换铝板就可继续使用
C. 负极反应式是:O2 + 2H2O+ 4e- = 4OH-
D. 铝片发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 molL-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀的pH | 1.5 | 4.3 | 6.9 |
完全沉淀的pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
请回答下列问题:
(1)实验需要配制250 mL 3.0 mol L-1的稀硝酸,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_______________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为__________________________________。
(3)步骤(b)首先加入试剂X调节溶液的pH约为6,原因是_______________________________,过滤后再继续加入X调节pH以得到绿色沉淀。
(4)NH3含量的测定: [已知:Ni(NH3)6Cl2+6HC1==NiCl2+6NH4Cl]。
i.用电子天平称量m g产品于锥形瓶中,用25 mL水溶解后加入3.00mL 6 mol/L的盐酸,以甲基橙作指示剂,滴定至终点消耗0.5000 molL-1的NaOH标准溶液V1mL;
ii.空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
①NH3的质量分数为______________(用含V1、V2、m的代数式表示)。
②在上述方案的基础上,下列措施能进—步提高测定准确度的有_______________(填选项字母)。
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量m g产品于锥形瓶中,用25 mL水溶解,___________,滴入23滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作23次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx,挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0 kJ·mol-1
2NO2(g)△H=+67.0 kJ·mol-1
③H2O(g)=H2O(l)△H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
① a表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示_______。
②阳极的电极反应式为____________________。
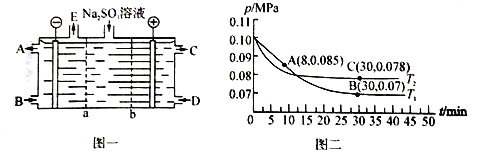
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为v0(正)_____vA(逆) (填“>"、“<”或“ = ”)。
③图中B点的压强平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com