
【题目】下列各组微粒中,核外电子总数相等的是( )
A.Na+和Li+
B.CO和CO2
C.H2O和H3O+
D.NO和CO
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】反应CO+H2O(g)CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
A.将压强减小至原来的一半
B.添加催化剂
C.将反应温度升高至1200 K
D.增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式___________________。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
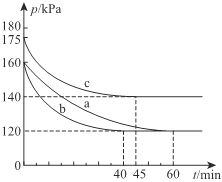
①与实验a相比,c组改变的实验条件可能是______________,判断的依据是______________________。
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为______________________。
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH=-42kJ·mol-1。
SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T2 | 0.20 | 0.30 | a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=__________,该温度下的平衡常数为______________。
②实验丙中,达到平衡时,NO2的转化率为_______________。
③由表中数据可推知,T1_____T2(填“>”“<”或“=”),判断的理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、SO![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________(填化学式),充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________(填化学式),充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO![]() ,其原因是__________________。
,其原因是__________________。
(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是________;电解时阳极反应式为_________________。反应Ⅲ的化学方程式为___________________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是_______________。
②上述步骤3中滴定终点的现象是______________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果________________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原ClO2溶液的浓度为 ________mol·L-1(用含字母的代数式表示)。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为___。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是( )
A.淀粉和纤维素均为天然高分子化合物
B.饮用矿泉水瓶的主要成分是聚氯乙烯
C.凡含有食品添加剂的食物均不可食用
D.大米煮成粥后,淀粉就变成了葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com