
【题目】用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是

A. 铜棒为正极,其电极反应式为2H++2e- = H2↑
B. 烧杯左侧碳棒为阴极,其电极表面有红色物质析出
C. 反应中消耗锌的质量为13 g
D. 导线中通过的电子的物质的量为0.2 mol
【答案】BC
【解析】试题分析:锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子放电,A正确;烧杯右侧碳棒与电源的负极相连为阴极,溶液中的铜离子放电,其电极表面有红色物质析出,B正确;反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,这说明惰性电极电解硫酸铜溶液时阳极是氢氧根放电产生氧气,阴极是铜离子放电析出铜,电极反应式分别为4OH--4e-=2H2O+O2↑、2Cu2++4e-=2Cu。根据原子守恒可知,析出铜的物质的量是0.1mol,则反应中转移电子的物质的量是0.2mol。根据电子守恒可知锌失去电子的物质的量也是0.2mol,消耗锌的质量是0.1mol×65g/mol=6.5g,故C错误;导线中通过电子的物质的量为0.2 mol,故D正确。


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
(1)用大理石和稀盐酸反应制CO2,产生CO2的体积与反应时间的关系如图所示,其中产生CO2速率最快的为____________段(选填“OE”、“EF”或“FG”),其主要原因为____________________,若要使该反应的反应速率加快,下列措施不可行的是______(选填序号);

①将大理石换用碳酸钙粉末 ②加入K2SO4溶液
③升高温度 ④加入NaCl固体
(2)请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,回答下列问题:
①该电池选择的电解质溶液为______(填化学式);
②负极材料为___________(填化学式),正极的电极反应式为______________;
③若导线上转移电子0.025mol,则生成银的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2 溶液没有白色沉淀产生 D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔的下列性质中,不同于乙烯和乙烷的是( )
A. 能燃烧生成二氧化碳和水B. 能跟溴水发生加成反应
C. 能跟高锰酸钾酸性溶液发生氧化反应D. 能与氯化氢反应生成氯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程如下。
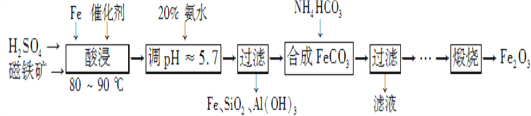
(1) 酸浸时,采用80-90℃的原因_______________________________________________;
铁粉的作用是____________________________________。
(2) 合成碳酸亚铁的离子方程式__________________________________________________________________。
(3) 图中“滤液”中主要阳离子是_______________________________________________________________;
(4)为了测定磁铁矿中铁的含量,称取80 g的磁铁矿样品加入足量稀硫酸使其充分溶解,过滤,得溶液100mL,取20mL溶液在酸性条件下用0.4 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
①写出滴定时反应的离子方程式__________________________________________
②当溶液中Fe2+ 全部被氧化时,c(Fe3+)=_____________________mol·L-1, (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2![]() 2NH3(正反应是放热反应).下列有关说法正确的是
2NH3(正反应是放热反应).下列有关说法正确的是
A. 升高温度能加快反应速率
B. 1mol N2和3mol H2的总能量低于2mol NH3的总能量
C. 达到化学反应限度时,生成2molNH3
D. 平衡时各组分含量之比一定等于3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究。
I.鉴别NaCl和NaNO2。
(1)用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2呈碱性。该溶液呈碱性的原因是_____________________________________(用离子方程式解释)。
(2)已知:Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10。分别向盛有5mL0.0001mol/L两种盐溶液的试管中逐滴滴加0.0001mol/L的硝酸银溶液,先生成沉淀的是装有____________溶液的试管。
(3)已知:2NaNO2+4HI==2NaI+I2+2NO↑+2H2O。根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有____________(填选项字母)
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E.食醋 F.白酒
Ⅱ.NaNO2与酸反应。
已知:NO+NO2+2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用如图所示仪器 (夹持装置己省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃。
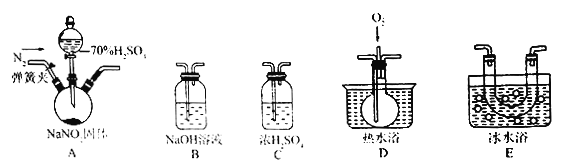
(1)按气流从左到右的方向,上述装置的连接顺序为A→___________→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是___________________________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体。
①依据__________现象,可确认产物中有NO。
②裝置E的作用是______________________ 。
(4)如果没有装置C,对实验结论的影响是______________________________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com