
【题目】金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是________,溶液中VO3-转化为V2O74-的离子方程式为________。

(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO3-转化为V2O74-、________(请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________。
②T℃时反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。

(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________色变为________色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______。

【答案】+5 2VO3-+2OH-=V2O74-+H2O V2O5+Na2CO3+2NH4Cl=2NH4VO3+2NaCl+CO2↑ pH过大,溶液中的NH4+会转化为NH3·H2O 2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g) △H=(p-q-r)kJ/mol 0.00125 绿 紫 1mol
【解析】
(1)根据化合物中元素化合价代数和等于0分析判断,根据图示,在碱性溶液中VO3-转化为V2O74-;
(2)V2O5、Na2CO3、NH4Cl混合发生反应产生NH4VO3、CO2气体及NaCl,据此书写反应方程式;根据NH4+与OH-不能大量共存分析;
(3)①根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
②SO3的平衡转化率为20%,则反应的三氧化硫为0.4mol,根据三段式计算平衡时各组分物质的量浓度,根据平衡压强,结合气体的物质的量、计算平衡浓度,带入平衡常数表达式K=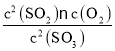 计算平衡常数;
计算平衡常数;
(4)充电时阳极发生氧化反应,阴极发生还原反应,根据不同价态离子的颜色判断;
(1)O元素化合价为-2价,则在V2O74-中V元素的化合价是(2×7-4)÷2=+5价;根据图示,在碱性溶液中VO3-转化为V2O74-,转化的离子方程式是2VO3-+2OH-=V2O74-+H2O;
(2)V2O5、Na2CO3、NH4Cl混合发生反应产生NH4VO3、CO2及NaCl,反应方程式为:V2O5+Na2CO3+2NH4Cl=2NH4VO3+2NaCl+CO2↑;根据图示可知:当溶液pH在8~10时, VO3-转化为V2O74-,同时溶液中的NH4+与OH-会发生反应,转化为弱电解质NH3·H2O;
(3)①(i)2SO2(g)+O2(g)![]() 2SO3(g)△H=pkJ/mol
2SO3(g)△H=pkJ/mol
(ii)V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
(iii)V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
根据盖斯定律,①-②-③得过程iii的反应为:2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g),△H=(p-q-r)kJ/mol;
②T℃时,将2molSO3置于10L密闭容器中,反应开始时,c(SO3)=2mol÷10L=0.2mol/L,反应达到平衡后,体系总压强为0.10MPa,此时SO3的平衡转化率为20%,则反应的三氧化硫的物质的量n(SO3)=2mol×20%=0.4mol,容器体积为10L,则△c(SO3)=0.4mol÷10L=0.04mol/L,平衡时c(SO3)=0.2mol/L-0.04mol/L=0.16mol/L,c(SO2)=0.04mol/L,c(O2)=0.02mol/L,则该反应的化学平衡常数K=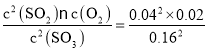 mol/L=0.00125mol/L
mol/L=0.00125mol/L
(4)①在充电时,右侧阴极上发生还原反应,V3+获得电子变为V2+,右侧会看到溶液由绿色变为紫色;
②充电时右侧发生还原反应:V3++e-=V2+,每转移1mol电子,右侧正电荷数目减少NA个,所以转移的电子数为NA个,溶液中H+会通过质子交换膜由左侧进入右侧,则左槽n(H+)的变化量为1mol。


科目:高中化学 来源: 题型:
【题目】在定温定容的密闭容器中合成SO3 ,下列能说明反应 2SO2(g)+O2(g)![]() 2SO3(g)达到化 学平衡状态的是
2SO3(g)达到化 学平衡状态的是
A.cSO2 :cO2 :cSO3 =2:1:2B.容器内的密度不再改变
C.SO2 的转化率不再改变D.SO3 的生成速率与 SO2 的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,电极反应为:
溶液,电极反应为:![]() ,
,![]() 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。

①下列叙述正确的是_______。
![]() .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极
![]() .使用过程中,电子由
.使用过程中,电子由![]() 极经外电路流向
极经外电路流向![]() 极
极
![]() .
.![]() 是负极,
是负极,![]() 是正极
是正极
![]() .
.![]() 电极发生还原反应,
电极发生还原反应,![]() 电极发生氧化反应
电极发生氧化反应
②写出电池的总反应式:________________________________________________________________ 。
③使用时,电解质溶液的![]() ________。
________。
(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是 _____________________________________________________________________;
②电解液中![]() 的浓度将变_______;
的浓度将变_______;
③当外电路通过![]() 电子时,理论上负极板的质量增加_______
电子时,理论上负极板的质量增加_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,CPAE是蜂胶的主要活性成分,也可由咖啡酸合成.下列说法不正确的是

A.咖啡酸分子中所有碳原子可能处在同一个平面上
B.1molCPAE与足量的溴水反应,最多消耗3molBr2
C.1mol苯乙醇在O2中完全燃烧,需消耗10molO2
D.1molCPAE与足量的NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。

(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾的化学式为K4[Fe(CN)6],一种用含NaCN废水合成该化合物的主要工艺流程如图:

请依据工艺流程图中的信息,回答下列问题:
①在“除杂”步骤中弃渣的主要成分为________(填化学式)。
②在“反应器”中发生的主要反应的化学方程式为_______________________。
③相同温度下溶解度:Na4[Fe(CN)6]________K4[Fe(CN)6](填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为![]() 的是
的是![]()
![]()
A.液面在“0”刻度时,![]() 碱式滴定管和
碱式滴定管和![]() 碱式滴定管所盛液体的体积
碱式滴定管所盛液体的体积
B.相同温度下,![]() 醋酸溶液和
醋酸溶液和![]() 醋酸溶液中的
醋酸溶液中的![]()
C.在![]() 溶液中,
溶液中,![]() 与
与![]()
D.相同温度下,等浓度的![]() 和NaOH溶液,前者与后者的
和NaOH溶液,前者与后者的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】央视报道《王者归“铼”》:中国发现超级金属“铼”,飞机火箭上天全靠它,有望打破美国垄断。
(1)铼(Re)被称为类锰元素,与锰的外围电子结构数相同,已知Mn的外围电子排布式为3d54s2,写出75Re的外围电子排布式:______,其最高价氧化物的化学式为_______。
(2)铢合金可作为醇脱氢反应的催化剂:CH3OH![]() HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
(3)实验中常用过硫酸盐氧化法测定钢铁中锰的含量,反应原理为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
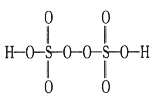
上述反应中S2O82-断裂的共价键类型为___(填“σ键”或“π键”),每生成0.3molMnO4-,过硫酸根中断裂的共价键数目为_____NA。
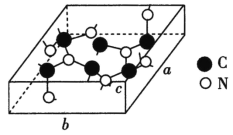
(4)科学家研制出一种新型的超硬材料,类似于金刚石的结构,但硬度比金刚石大,该晶体元素组成为C和N,其晶胞如图所示(图示原子都包含在晶胞内),则该晶胞所含氮原子的个数为____。已知晶胞参数分别为a nm、b nm、c nm,,该晶体的摩尔质量为Mg·mol-1,密度为ρg·cm-3,则阿伏加德罗常数的数值为___(用含a、b、c、ρ、M的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com