
【题目】在定温定容的密闭容器中合成SO3 ,下列能说明反应 2SO2(g)+O2(g)![]() 2SO3(g)达到化 学平衡状态的是
2SO3(g)达到化 学平衡状态的是
A.cSO2 :cO2 :cSO3 =2:1:2B.容器内的密度不再改变
C.SO2 的转化率不再改变D.SO3 的生成速率与 SO2 的消耗速率相等
【答案】C
【解析】
根据化学平衡状态的特征:当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A.当体系达平衡状态时,SO、O2和SO3的物质的量之比可能为2:1:2,也可能不是2:1:2,与各物质的初始浓度及转化率有关,故A不选;
B.反应过程中,气体的质量和容器的体积始终保持不变,容器内的密度不再改变,不能确定是否到达平衡状态,故B不选;
C.SO2的转化率不再改变,正逆反应速率相等,达平衡状态,故C选;
D.只要反应发生就有SO3的生成速率与SO2的消耗速率相等,故D不选;
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80%
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则Ksp(AgI)<Ksp(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2 L的密团容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。据图可知

A. 该反应的化学方程式为N(g) ![]() 2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
2M(g) B. t1~t2时间内,v(M)=(1/t2-t1) mol·L-1·min-1
C. t2时,正逆反应速率相等,反应达平衡状态 D. 平衡时,物质N的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成![]() 和
和![]() ,化学方程式如下:
,化学方程式如下:![]() 某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
B.在该温度下,反应的平衡常数![]()
C.若将NO和CO的起始投料量均加倍,则平衡时NO转化率小于![]()
D.使用催化剂可以提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的现象和结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 测定等浓度的 |
| 非金属性: |
B | 将稀硫酸加入到碳酸钙中,排饱和食盐水收集气体 | 收集到一定量气体 | 实验室可用此法制备 |
C | 将4mL |
| 增大反应物浓度, 反应速率加快 |
D | 将 | 溶液变红 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强B. 混合气体密度
C. A的物质的量浓度保持不变D. 气体总物质的量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的某容积不变的密闭容器中,建立下列化学平衡 C(s)+H2O(g)![]() CO(g)+H2(g),下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
CO(g)+H2(g),下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
A.体系的压强不再发生变化B.气体密度不再改变
C.生成n mol CO的同时生成n mol H2D.1 mol H–H键断裂的同时断裂2 molH–O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:
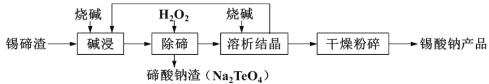
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。

(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。

(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是________,溶液中VO3-转化为V2O74-的离子方程式为________。

(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO3-转化为V2O74-、________(请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________。
②T℃时反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。

(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________色变为________色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com