
| A、联合制碱法的优点是减少了对设备的腐蚀 |
| B、工业生产硫酸时,用98%硫酸的来吸收三氧化硫,可以避免形成酸雾并提高吸收率 |
| C、合成氨是天然固氮的方法之一 |
| D、碳酸钠俗称小苏打,甲烷是一种清洁能源 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| A、离子键就是使阴、阳离子结合成化合物的静电引力 |
| B、所有金属与所有非金属之间都能形成离子键 |
| C、在化合物CaCl2中,两个氯离子之间也存在离子键 |
| D、钠原子与氯原子结合成氯化钠后体系能量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| W | Y |
| Y的氢化物 | 一元酸HA |
| Ka1=9.1×10-8,Ka2=1.1×10-12 | Ka=1.1×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ”表示硝基、用“…”表示氢键,画出C2分子的结构
”表示硝基、用“…”表示氢键,画出C2分子的结构 和
和  ,写出另3种同分异构体的结构简式
,写出另3种同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
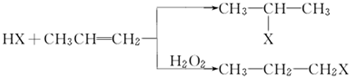
 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com