
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示: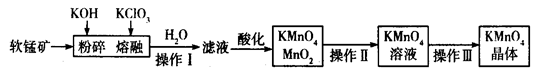
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
(10分)
(1)b (1分)
(2) 过滤(1分) 过滤(1分) 蒸发(1分)
(3)KClO3(1分);3MnO42-+4H+=2MnO4-+MnO2↓+2H2O(2分)
(4)96(3分)
解析 试题分析:(1)高锰酸钾能氧化盐酸和氢硫酸,硝酸本身具有强氧化性,故选硫酸;(2) 由进行操作Ⅰ后得滤液,故操作Ⅰ应为过滤,由于MnO2难溶于水操作Ⅱ后得KMnO4溶液,故操作Ⅱ为过滤,进行操作Ⅲ后使溶液变成了晶体,故操作Ⅲ为蒸发;(3)由产物及元素的化合价可知氧化剂应为KClO3,滤液中主要成分是K2MnO4,酸化后得到KMnO4和MnO2,故方程式为:3MnO42-+4H+=2MnO4-+MnO2↓+2H2O;(4)由题意及电子守恒可得关系式为:
试题分析:(1)高锰酸钾能氧化盐酸和氢硫酸,硝酸本身具有强氧化性,故选硫酸;(2) 由进行操作Ⅰ后得滤液,故操作Ⅰ应为过滤,由于MnO2难溶于水操作Ⅱ后得KMnO4溶液,故操作Ⅱ为过滤,进行操作Ⅲ后使溶液变成了晶体,故操作Ⅲ为蒸发;(3)由产物及元素的化合价可知氧化剂应为KClO3,滤液中主要成分是K2MnO4,酸化后得到KMnO4和MnO2,故方程式为:3MnO42-+4H+=2MnO4-+MnO2↓+2H2O;(4)由题意及电子守恒可得关系式为:
2KMnO4~5NaC2O4
2×158 5×134
m 0.67g
解得m=0.316g
KMnO4的纯度为0.316/0.33×100%=86%
考点:考查氧化还原反应及计算、化学实验基本操作等知识点。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:填空题
海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图:
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、__ ___(填试剂化学式),然后__ ___(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋植物如海带、海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2)操作③中所用的有机试剂可以是 (只填一种),简述选择其理由 。
(3)操作过程③可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
选择下列物质分离和检验方法,将其选项填在横线上。
| A.萃取; | B.升华; | C.结晶; | D.分液;E.蒸馏;F.层析;G.过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物
填空和回答下列问题:
(1)B物质是 (写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。
(4)请写出从B到C的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作A是_________________(填实验基本操作名称)。用何种方法知道海水晒盐的过程中溶液里食盐含量在逐渐提高?________
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是____________________________,操作C是_______________________________。
(4)上图中虚线框内流程的主要作用是_______________________;与之目的相同的流程在上图中还有几处,试指出其中一处________________________。
(5)将MgCl2转化为Mg时获得的副产品是_____________,用化学方程式表示该物质的某种用途______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:
(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80?90℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离吋液溴从分离器的 (填“上口”或“下口”)排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g·L-1,已知步骤①?⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:
(2)观察到A中的现象是 _______________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com