
选择下列物质分离和检验方法,将其选项填在横线上。
| A.萃取; | B.升华; | C.结晶; | D.分液;E.蒸馏;F.层析;G.过滤 |
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作1的名称为 。操作2用到的玻璃仪器有烧杯和
(2)“浸出”步骤中,为提高铜的浸出率,可采取的措施有
(3)比较操作2之前与操作3之后的溶液,说明两步骤主要目的是 。
(4)取少量所得溶液A,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)(不考虑除注明外的其它杂质干扰)
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL.
滴定反应:Cu2+ + H2Y2– CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
A.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
B.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
C.滴定前,滴定管尖端有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施__________、______________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O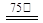 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤干净的依据是 _________________。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有: 和 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。实验中可选用的试剂如下: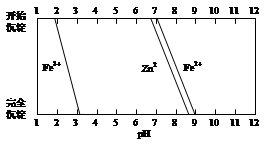
a.30%H2O2;
b.新制氯水;
c.1.0 mol·L-1NaOH溶液;
d.3 mol·L-1稀硫酸;
e.纯ZnO粉末;
f.纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3 mol·L-1稀硫酸,加入 (选填字母,下同);②加入 ;③加热到60℃左右并不断搅拌;④过滤得ZnSO4溶液。其中步骤③加热的主要目的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)用CCl4提取溴水中的溴,可采用 的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用 和 的方法除去。
(4)除去氧化钙中的碳酸钙可用 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示: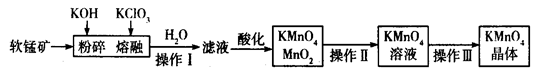
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3、⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,她能成功吗? (填“能”或“不能”)。
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ,有一组在混合时.随着试剂滴加后的时间不同而出现明显不同的现象,该组是为 ,该组涉及氧化还原应的化学方程式 。
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
(4)以下各种溶液不用任何外加试剂,就能实现鉴别的是
①Al(NO3)3 FeCl3 NaOH FeSO4 NaHCO3
②Na2CO3 BaCl2 AgNO3 Na2SO4 NH3·H2O
③KOH NaCl NaHCO3 MgSO4 KNO3
④CuSO4 KHSO4 NaHCO3 KOH
⑤NaAlO2 Na2SiO3 Na2CO3 NaHSO4 NaCl
⑥NH4Cl Na2SO4 (NH4)2SO4 Ba(OH)2 AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: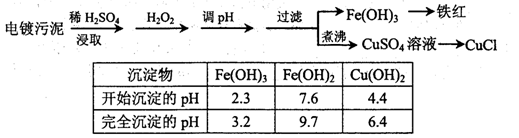
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。通过计算说明该CuCl样品 (填“符合”或“不符合”)国家标准。
(4)25℃时,KSP [Fe(OH)3]= 4.0×10-38。Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数为 。
Fe(OH)3+3H+,该反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)(2012?山东)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: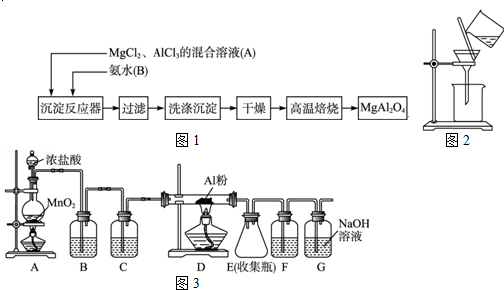
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B”),再滴加另一反应物.
(2)如下图所示,过滤操作中的一处错误是 .
(3)判断流程中沉淀是否洗净所用的试剂是 .高温焙烧时,用于盛放固体的仪器名称是 .
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
装置B中盛放饱和NaCl溶液,该装置的主要作用是 .F中试剂的作用是 .用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com