
化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:填空题
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、SO42—和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下:
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+??2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)??Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: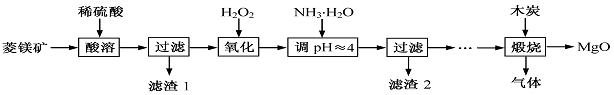 (1)MgCO3与稀硫酸反应的离子方程式为 。
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:2MgSO4+C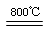 2MgO+2SO2↑+CO2↑、MgSO4+C
2MgO+2SO2↑+CO2↑、MgSO4+C MgO+SO2↑+CO↑、 MgSO4+3C
MgO+SO2↑+CO↑、 MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。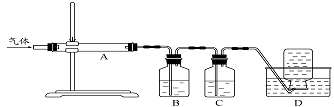
利用上图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施__________、______________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: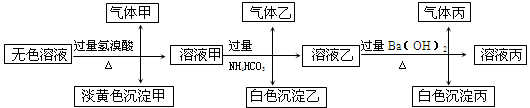
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O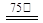 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤干净的依据是 _________________。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有: 和 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。实验中可选用的试剂如下: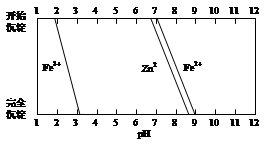
a.30%H2O2;
b.新制氯水;
c.1.0 mol·L-1NaOH溶液;
d.3 mol·L-1稀硫酸;
e.纯ZnO粉末;
f.纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3 mol·L-1稀硫酸,加入 (选填字母,下同);②加入 ;③加热到60℃左右并不断搅拌;④过滤得ZnSO4溶液。其中步骤③加热的主要目的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示: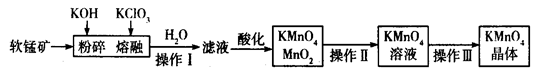
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下面的框图是测定CuSO4·xH2O中结晶水含量的实验流程。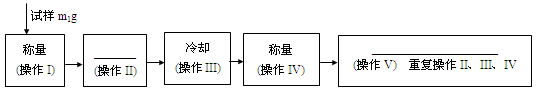
40. 填写流程中空白的操作名称:(操作II)_____________; (操作V)___________________。
41. 其加热装置正确的是____________(填写编号)。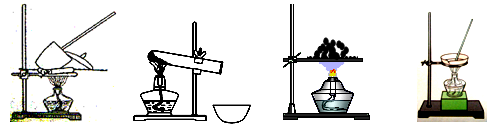
a b c d
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过______g。
43. 操作III必须要在_______(填仪器名称)中进行。
44. 以下胆矾结晶水含量的测定操作正确的是____________(填写编号)。
a. 加热时,晶体溅出坩埚,再加些胆矾
b. 加热时,先用小火,后用大火加热至最后
c. 加热时,不断用玻璃棒搅拌
45. 若实验测得的硫酸铜晶体中结晶水含量偏高,可能的原因有__________(填写编号,下同);若实验测得的硫酸铜晶体中结晶水含量偏低,可能的原因有____________。
a.晶体未完全变白就停止加热
b.加热过程中有少量晶体溅出
c.加热后在空气中自然冷却
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com