
【题目】奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
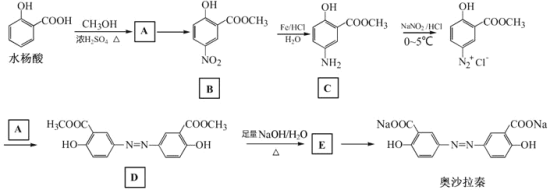
回答下列问题:
(1)A的结构简式为_________;由A制备B的反应试剂和条件为_______________。反应类型为_________。
(2)工业上常采用廉价的CO2与E反应制备奥沙拉秦,通入的CO2与E的物质的量之比至少应为_________。
(3)奥沙拉秦的分子式为_________,其核磁共振氢谱为_______组峰,峰面积比为__________。
(4)若将奥沙拉秦用HCl酸化后,分子中含氧官能团的名称为________________。
(5)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为___________。
(6)写出下列反应的化学方程式:
由水杨酸制备A:____________________________________。
由D生成E:________________________________________。
【答案】 浓硫酸,浓硝酸,加热 取代反应 2∶1 C14H8N2O6Na2 4 1∶1∶1∶1 羧基 羟基
浓硫酸,浓硝酸,加热 取代反应 2∶1 C14H8N2O6Na2 4 1∶1∶1∶1 羧基 羟基 ![]()
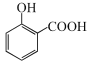 +CH3OH
+CH3OH![]()
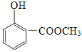 +H2O
+H2O 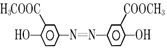 +4NaOH
+4NaOH![]()
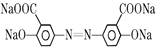 +2CH3OH+2H2O
+2CH3OH+2H2O
【解析】
对比水杨酸、B的结构,结合反应条件,可知水杨酸与甲醇发生酯化反应生成A: ,A发生硝化反应生成B:
,A发生硝化反应生成B: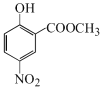 ,B在Fe、HCl、H2O存在条件下-NO2被还原为-NH2,产生C:
,B在Fe、HCl、H2O存在条件下-NO2被还原为-NH2,产生C: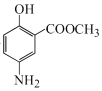 ;C在NaNO2/HCl,并加热在0~5℃时反应产生
;C在NaNO2/HCl,并加热在0~5℃时反应产生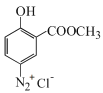 ,
, 与
与 反应产生D:
反应产生D: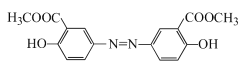 ,D与足量NaOH的水溶液混合加热发生反应产生E是
,D与足量NaOH的水溶液混合加热发生反应产生E是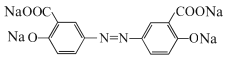 ,向该物质的水溶液中通入足量CO2气体,利用酸性:羧酸>H2CO3>苯酚,发生复分解反应产生目标产物奥沙拉秦
,向该物质的水溶液中通入足量CO2气体,利用酸性:羧酸>H2CO3>苯酚,发生复分解反应产生目标产物奥沙拉秦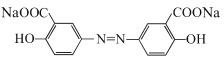 。
。
根据上述分析可知:A是 ,E是
,E是
(1)对比水杨酸、B的结构,结合反应条件,可知水杨酸与甲醇发生酯化反应生成A,所以A的结构简式为: ;A与浓硝酸、浓硫酸混合加热发生取代反应生成B,该取代反应又叫硝化反应,所以由A制备B的反应试剂和条件为:浓硝酸、浓硫酸、加热,反应类型为取代反应;
;A与浓硝酸、浓硫酸混合加热发生取代反应生成B,该取代反应又叫硝化反应,所以由A制备B的反应试剂和条件为:浓硝酸、浓硫酸、加热,反应类型为取代反应;
(2)由于酸性:羧酸>H2CO3>C
(3)由奥沙拉秦的结构,可知其分子中有14个C原子、8个H原子、2个N原子、6个O原子、2个Na原子,其分子式为:C14H8N2O6Na2;该物质分子关于氮氮双键对称,分子有4种化学环境不同的H原子,峰面积之比等于H原子数目之比为1:1:1:1;
(4)由于酸性:HCl>羧酸>H2CO3>C6H5OH,所以若将奥沙拉秦用HCl酸化后可得到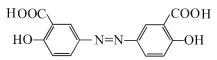 ,该物质分子中含氧官能团为-COOH、-OH,名称为羧基、羟基;
,该物质分子中含氧官能团为-COOH、-OH,名称为羧基、羟基;
(5)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。说明W分子中-OH、-OOCH处于对位的结构简式为![]() ;
;
(6)由水杨酸制备A的反应化学方程式: +CH3OH
+CH3OH![]()
 +H2O;由D生成E的反应化学方程式:
+H2O;由D生成E的反应化学方程式: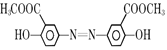 +4NaOH
+4NaOH![]()
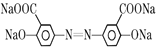 +2CH3OH+2H2O。
+2CH3OH+2H2O。


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
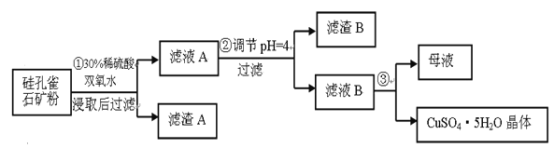
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4+_______+H2O;双氧水的作用是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A.CuO | B.Fe2O3 | C.Al2O3 | D.Cu(OH)2 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为_____,滤液B中除Cu2+外, 还含有的金属阳离子是_______。
(4)将滤液B通过________、_______,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2A和H2NCH2CH2NH2溶液中各组分的物质的量分数δ随pH的变化如图(I)、(II)所示。下列说法不正确的是已知:![]() 。
。
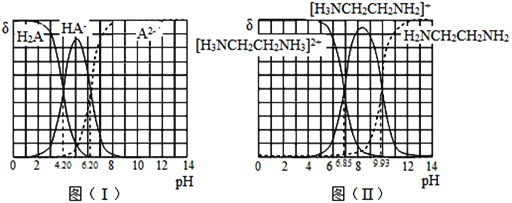
A.NaHA溶液中各离子浓度大小关系为:![]()
B.乙二胺(H2NCH2CH2NH2)的Kb2=10-7.15
C.[H3NCH2CH2NH3]A溶液显碱性
D.向[H3NCH2CH2NH2] HA溶液中通人HCl,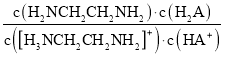 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
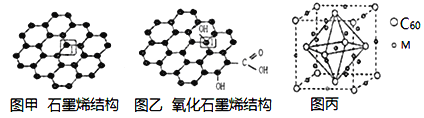
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
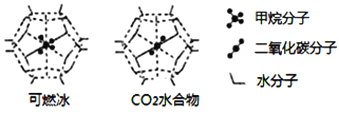
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知2C(s)+2O2(g) == 2CO2(g) ΔH1, 2C(s)+O2(g)==2CO(g) ΔH2,则ΔH1<ΔH2
C. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D. 已知C(石墨,s) == C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向体积均为15.0mL,浓度均为1.00mol/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是

A. 曲线a是NaHCO3溶液的滴定曲线
B. 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
C. 当V(盐酸)=15.00mL时,c(Na+)=c(NH4+)
D. 两个滴定过程均可选择酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能实现的是( )
A. 图1装置左侧用于检验氯化铵受热分解出的氨气
图1装置左侧用于检验氯化铵受热分解出的氨气
B.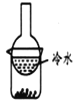 图2装置用于分离碘单质和高锰酸钾固体混合物
图2装置用于分离碘单质和高锰酸钾固体混合物
C.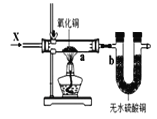 图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
D. 图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com