
【题目】下列实验能实现的是( )
A. 图1装置左侧用于检验氯化铵受热分解出的氨气
图1装置左侧用于检验氯化铵受热分解出的氨气
B.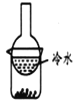 图2装置用于分离碘单质和高锰酸钾固体混合物
图2装置用于分离碘单质和高锰酸钾固体混合物
C.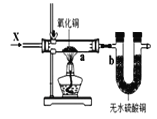 图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
D. 图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲酸是原子利用率高的反应,且生成的甲酸是重要化工原料。下列说法不正确的是( )

A. 二氧化碳的电子式: ![]()
B. 在捕获过程,二氧化碳分子中的共价键完全断裂
C. N(C2H5)3能够协助二氧化碳到达催化剂表面
D. CO2催化加氢合成甲酸的总反应式:H2+CO2=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
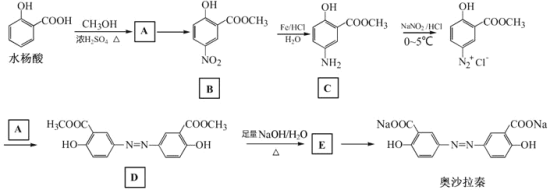
回答下列问题:
(1)A的结构简式为_________;由A制备B的反应试剂和条件为_______________。反应类型为_________。
(2)工业上常采用廉价的CO2与E反应制备奥沙拉秦,通入的CO2与E的物质的量之比至少应为_________。
(3)奥沙拉秦的分子式为_________,其核磁共振氢谱为_______组峰,峰面积比为__________。
(4)若将奥沙拉秦用HCl酸化后,分子中含氧官能团的名称为________________。
(5)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为___________。
(6)写出下列反应的化学方程式:
由水杨酸制备A:____________________________________。
由D生成E:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果不正确的是( )
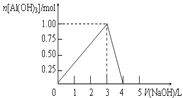
A. 反应过程中,沉淀最多时的质量为78g
B. 反应过程中,Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为3.5L
C. AlCl3溶液的浓度为2.0mol/L
D. 当V(NaOH)=4.0L时,得到的溶液中Na+、Cl-浓度一定不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
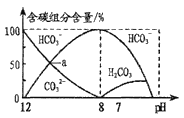
下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g)![]() pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
A.体系的压强不再改变B.各组分的浓度不再改变
C.反应速率υA : υB : υC : υD = m : n : q : pD.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有离子:K+、Na+、Fe2+、Fe3+、SO32-、SO42-,且溶液中各离子的物质的量相等,将此溶液分为两份,一份加高锰酸钾溶液,现象为紫色褪去,另一份加氯化钡溶液,产生了难溶于水的沉淀。下列说法正确的是( )
A.若溶液中含有硫酸根,则可能含有K+
B.若溶液中含有亚硫酸根,则一定含有K+
C.溶液中可能含有Fe3+
D.溶液中一定含有Fe2+和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2X(g)+Y(g)![]() 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
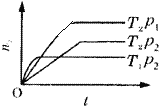
下述判断正确的是( )
A.T1>T2,p1>p2B.T1<T2,p1>p2
C.T1<T2,p1<p2D.T1>T2,p1<p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
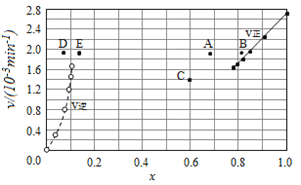
A. A D B. B D C. B E D. A E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com