
【题目】“臭碱![]() ”广泛应用于冶金染料、皮革、电镀等工业,可利用反应
”广泛应用于冶金染料、皮革、电镀等工业,可利用反应![]() 制备。已知
制备。已知![]() ,
,![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中生成1 mol“臭碱”时转移电子数为![]()
B.该反应的氧化产物与还原产物的物质的量比为![]()
C.![]() 溶液中含有的阴离子数目大于
溶液中含有的阴离子数目大于![]()
D.将![]() 溶液露置于空气中不会有
溶液露置于空气中不会有![]() 气体放出
气体放出
【答案】C
【解析】
A.根据反应方程式,生成1 mol“臭碱”时,S的化合价由+6价变为-2价,共转移8mol电子,即转移的电子数为8NA,A选项错误;
B.该反应的氧化产物为CO2,还原产物为Na2S,有方程式可知,其物质的量之比为2:1,B选项错误;
C.1L 0.1mol·L-1Na2S溶液中S2-发生水解:S2-+H2O![]() HS-+OH-,阴离子总数大于0.1NA,C选项正确;
HS-+OH-,阴离子总数大于0.1NA,C选项正确;
D.因为Ka1(H2S)<Ka1(H2CO3),则H2S的酸性比碳酸弱,将Na2S溶液露置于空气中,会发生反应:CO2+Na2S+H2O===Na2CO3+H2S,有H2S气体放出,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
D.2C6H6 + 15O2![]() 12CO2 +6H2O
12CO2 +6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
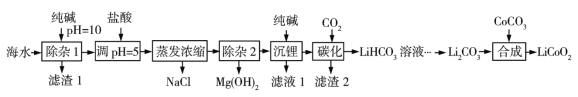
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
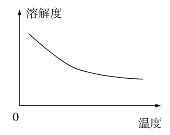
②碳酸锂的溶解度与温度关系如图所示。
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一固定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A.SO2和SO3共2 mol
B.生成SO3 2 mol
C.放出197 kJ热量
D.含氧原子共12 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。抗击疫情要戴口罩,勤洗手,下列有关说法正确的是( )
A.新型冠状病毒可能通过气溶胶传播,说明病毒的粒子直径可能在纳米级范围内
B.为增强消毒效果可将医用消毒酒精与84消毒液混合使用
C.甲醛和戊二醛可杀灭多种病原体,可用于空气、餐具的消毒
D.可用铝制容器配制过氧乙酸(![]() )消毒剂
)消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H=akJ/mol,平衡常数为K;测得在不同温度下,K值如下:
FeO(s)+CO(g) △H=akJ/mol,平衡常数为K;测得在不同温度下,K值如下:
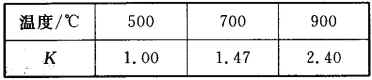
(1)若500℃时进行上述反应,CO2起始浓度为1 mol/L,CO的平衡浓度为_____。
(2)方程式中的a________0(填“大于”“小于”或“等于”)。
(3)900℃上述反应达到平衡,要使得该平衡向左移动,其他条件不变时,可以采取的措施有________(填序号)
A.缩小反应器体积 B.加入FeO
C.降低温度到500℃ D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案的设计能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 验证 | 向 |
B | 比较HF与 | 常温下,用pH试纸分别测定浓度均为 |
C | 验证 | 向 |
D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
A. Fe3O4的物质的量不变 B. V(H2O)=V(H2)
C. 反应不再进行 D. 容器内压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________(至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)![]() B(l)ΔH1 O2(g)+B(l)
B(l)ΔH1 O2(g)+B(l)![]() A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)
A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)![]() H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com