
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
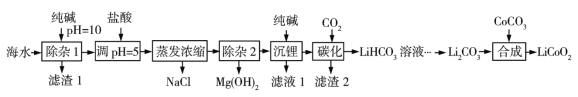
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
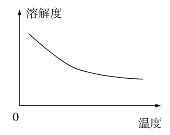
②碳酸锂的溶解度与温度关系如图所示。
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
【答案】+3 MnCO3 除去过量的Na2CO3,避免蒸发浓缩时析出Li2CO3 热水 ③ 6.0×108 2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2
4LiCoO2+6CO2
【解析】
海水(含浓度较大的 LiCl,含少量MgCl2、CaCl2、MnCl2等)中加入纯碱调pH=10,滤渣 1 主要成分有MgCO3、Mg(OH)2、CaCO3和MnCO3,滤液含Li2CO3,加盐酸调pH=5,蒸发浓缩,除去NaCl,再除去Mg(OH)2,加入纯碱生成Li2CO3,通入CO2,生成LiHCO3溶液,最后生成碳酸锂,加入碳酸钴,高温可生成LiCoO2,以此解答该题。
(1)钴酸锂( LiCoO2)中Li元素化合价为+1价,O元素化合价为-2价,该化学式中各元素的化合价的代数和为0,Co元素化合价=2×2-1=+3,由表中溶度积知,碳酸锰难溶于水,因此滤渣1中主要有MgCO3、Mg(OH)2、CaCO3和MnCO3;答案为+3,MnCO3。
(2)加入盐酸除去过量的碳酸钠,否则碳酸锂会在浓缩时析出,损失锂元素;答案为:除去过量的Na2CO3,避免蒸发浓缩时析出Li2CO3。
(3)碳酸锂在水中的溶解度,随温度升高,碳酸锂溶解度减小,“沉锂“时的温度应选高温,用热水洗涤,减少沉淀损失;从投料比看出,序号③的比例中,投入碳酸钠量较小,锂回收率较高,可降低生产成本;答案为热水,③。
(4)pH=13 时,c(OH-)=0.1mol/L,由溶度积可知,“除镁”是将溶液中Mg2+转化为Mg(OH)2沉淀,根据溶度积计算,c(Mg2+)=![]() =
= ![]() =6.0×10-8mol/L;答案为6.0×10-8。
=6.0×10-8mol/L;答案为6.0×10-8。
(5)将Li2CO3与CoCO3混合,再在空气中灼烧可得LiCoO2,Co元素化合物由+2价升高到+3价,发生氧化反应,必有氧气参加反应,反应还生成二氧化碳,反应化学方程式为:2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2;答案为:2Li2CO3+4CoCO3+O2
4LiCoO2+6CO2;答案为:2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2。
4LiCoO2+6CO2。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】恒温恒压下,对于反应:A(g)+3B(g)![]() 3C(g),达到平衡状态的标志是( )
3C(g),达到平衡状态的标志是( )
A.v正(A)=3v逆(C)
B.密闭容器内气体的密度不再改变
C.单位时间内消耗3nmolC的同时,生成3n molB
D.密闭容器内A、B、C气体的浓度之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面四种变化中,有一种变化与其他三种变化类型不同的是( )
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr→CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月9日,南京大学物理学院高力波教授团队,探索出了一种可控生长超平整石墨烯的方法,该方法有望推广到新材料、新能源等重要研究领域。
(1)如图图1和图2所示,科学家可以用特殊的胶带将石墨不断地粘撕得到石墨烯,是因为___。
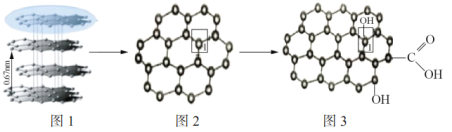
(2)石墨烯中碳原子的杂化方式为___,12g石墨烯中含有___个如图所示的六元环。
(3)石墨晶体中碳碳键的键长___金刚石晶体中碳碳键的键长(填“>”“<”或“=”),原因是___。
(4)如图图2和图3中,石墨烯转化为氧化石墨烯时,1号C与其相邻C原子间键能的变化是___(填“变大”、“变小”、“不变”)。
(5)曹原等研制得了具有超导特性的双层石墨烯新材料,手机一旦装上石墨烯电池,充电时间将被缩短为16分钟。将石墨烯逐层叠起来就是石墨,如图图4是石墨晶体的六方晶胞结构。

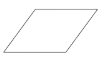
①在下列四边形内画出石墨晶胞沿c轴的投影___(用“”标出碳原子位置)。
②如果石墨晶胞中最近的两个碳原子之间的距离为apm,层间距为bpm,那么石墨晶体的密度为___ g·cm-3(列出计算式即可))。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在用硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.还原剂是![]() 和
和![]() ,氧化剂是
,氧化剂是![]()
C.氧化产物是S,还原产物是![]() 和
和![]()
D.当转移![]() 时,有
时,有![]() 参加反应
参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
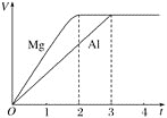
A. 二者物质的量之比为3∶2
B. 二者质量之比为3∶2
C. 二者摩尔质量之比为2∶3
D. 二者消耗H2SO4的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )
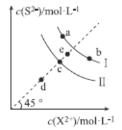
A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“臭碱![]() ”广泛应用于冶金染料、皮革、电镀等工业,可利用反应
”广泛应用于冶金染料、皮革、电镀等工业,可利用反应![]() 制备。已知
制备。已知![]() ,
,![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中生成1 mol“臭碱”时转移电子数为![]()
B.该反应的氧化产物与还原产物的物质的量比为![]()
C.![]() 溶液中含有的阴离子数目大于
溶液中含有的阴离子数目大于![]()
D.将![]() 溶液露置于空气中不会有
溶液露置于空气中不会有![]() 气体放出
气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com