
【题目】氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________(至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)![]() B(l)ΔH1 O2(g)+B(l)
B(l)ΔH1 O2(g)+B(l)![]() A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)
A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)![]() H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________。
【答案】 污染小;可再生;来源广;资源丰富;燃烧热值高 H2+2OH--2e-=2H2O < ac 光能转化为化学能 阳极室 防止Na2FeO4与H2反应使产率降低 M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)
【解析】试题分析:(1)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O,故答案为:污染小;可再生;来源广;资源丰富;燃烧热值高;H2+2OH--2e-=2H2O
(2)①H2(g)+A(l)=B(l) ΔH1,②O2(g)+B(l)=A(l)+H2O2(l) ΔH2,两反应的ΔS<0,根据ΔG=ΔHTΔS,因为均为两反应自发反应,因此ΔH均小于0,将①+②得:H2(g)+ O2(g)= H2O2(l)的ΔH=ΔH1+ΔH1<0,故答案为:<;
(3)MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。a.平衡时气体的物质的量不变,压强不变,正确;b.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;c.降低温度,平衡向正反应方向移动,平衡常数增大,正确;d.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;故选ac;
MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。a.平衡时气体的物质的量不变,压强不变,正确;b.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;c.降低温度,平衡向正反应方向移动,平衡常数增大,正确;d.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;故选ac;
(4)利用太阳能直接分解水制氢,是将光能转化为化学能,故答案为:光能转化为化学能;
(5)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH)降低的区域在阳极室,故答案为:阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,故答案为:防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,故答案为:M点:c(OH-)低,Na2FeO4稳定性差,且反应慢(或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
A.稀硫酸
B.CuSO4溶液
C.Fe2(SO4)3溶液
D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于物理变化的是( )
①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯制备聚乙烯
⑥将氧气转化为臭氧 ⑦乙烯催熟果实 ⑧蛋白质的盐析 ⑨海水蒸馏制取淡水
A.①②③④B.①②⑤⑦
C.①⑧⑨D.①②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100molL-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B. c(Na+)=0.100 molL-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C. c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 molL-1+c(HC2O4-)
D. pH=7的溶液中:c(Na+)=2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是化学学科的重要特征。
Ⅰ.根据下列装置图,回答有关问题:
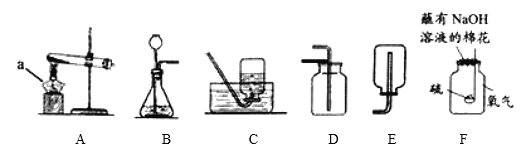
(1)a仪器的名称是________。
(2)如用装置A制取氧气,其反应的化学方程式为_______________________________;如用装置B制取氧气,往长颈漏斗中倒入的液体药品是__________;如用装置D收集氧气,则验满的方法是_____________________________。
(3)小明用装置F做硫在氧气中燃烧的实验,该改进实验最大优点是________________。
Ⅱ.粗盐提纯中得到的“精盐”常还含有可溶性杂质(假设只有CaCl2一种),为得到更纯净的氯化钠,同学们做了如下处理:
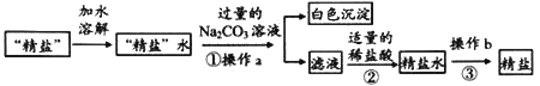
(1)操作b的名称是_________。
(2)步骤①加入过量的Na2CO3溶液的目的是________________。
(3)步骤②反应的化学方程式:___________________________。
(4)如何证明经过步骤②后过量的Na2CO3已除尽?_________________________(写出实验操作、现象、结论)。
(5)若不考虑损耗,经过上述处理得到的精盐质量_______(填“大于”、“小于”或“等于”)原“精盐”质量,原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
降凝剂是指能降低润滑油凝固点的化学品,一般是高分子有机化合物,降凝剂I是两种物质加聚得到的高分子化合物,通常加入油品中以降低凝固点,扩大燃料油品的使用范围,为合成得到降凝剂I,设计了以烯烃A为起始原料的合成路线:

试写出:
(1) A的名称:________________,B→C的反应条件:____________________。
F中含有的官能团名称:______________________。
(2) E可以在一定条件下合成高聚物J,写出反应的化学方程式:_______________________。
(3) H是一种核磁共振氢谱一组峰的五元环状结构,写出降凝剂I的结构简式:____________。
(4) F有多种同分异构体,其中①能与NaOH溶液反应但不能与NaHCO3溶液反应②能使溴水褪色的同分异构体有______种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之为1∶1∶2∶2与NaOH溶液反应的化学方程式:____________________________________。
(5) 请结合合成路线写出由苯乙醇、乙醇为原料合成 的最合理方案。___________________ (其他无机试剂任选)
的最合理方案。___________________ (其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2;2FeCl2 + Cl2 = 2FeCl3。判断下列物质的氧化性由强到弱的顺序是( )
A.Cl2>Fe3+>I2 B.Fe3+>Cl2>I2 C.Fe3+>I2>Cl2 D. Cl2>I2> Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以黄铜矿(主要成分是CuFeS2)为原料制备粗铜,进一步以粗铜为原料制备CuSO4·5H2O晶体。工艺流程如下(部分操作和条件略):
I. 煅烧黄铜矿,得到粗铜(含铁及铁、铜的化合物等);
II. 向粗铜中加入稀H2SO4和稀HNO3,并使产生的NO与H2O、O2反应;
III. 调节Ⅱ中所得溶液的pH,过滤;
Ⅳ. 将Ⅲ中滤液浓缩后冷却结晶,过滤,得到CuSO4·5H2O晶体。
已知:生成氢氧化物的pH
Cu(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.8 | 1.5 |
完全沉淀时 | 6.7 | 2.8 |
注:金属离子的起始浓度为0.1 mol/L
请回答:
(1)I中主要发生如下两个化学反应。请将反应ii的化学方程式补充完整。
i. 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii. ![]() Cu2S+
Cu2S+![]() O2
O2 ![]()
![]() _________+
_________+ ![]() SO2
SO2
(2)II中NO与H2O、O2反应的化学方程式是_________。
(3)III中的滤渣主要是Fe(OH)3。调节溶液的pH时,pH范围是_________。
(4)有关上述过程的说法中,正确的是_________(填序号)。
a. I中尾气含有SO2,可综合利用制备H2SO4。
b. II中稀HNO3的作用之一是使Cu单质转化为Cu2+
c. 在上述过程中,HNO3可循环利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com