
【题目】把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
A.稀硫酸
B.CuSO4溶液
C.Fe2(SO4)3溶液
D.AgNO3溶液
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
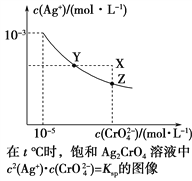
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,有类似氨的性质。已知:25℃时,Kb1=10-4.07Kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误的是

A. H2NCH2CH2NH2在水溶液中第一步电离的方程式为:H2NCH2CH2NH2+H2O![]() H2NCH2CH2NH3++OH-
H2NCH2CH2NH3++OH-
B. 曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+
C. 曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07
D. 在0.1mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>(H2NCH2CH2NH3+) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种处理高浓度乙醛废水的方法——隔膜电解法,其原理如图所示,电解质溶液为一定浓度含乙醛的Na2SO4溶液,电解后乙醛在两个电极分別转化为乙醇和乙酸。下列说法正确的是

A. a电极为阴极,b电极为阳极
B. 阳极的电极反应式为CH3CHO-2e-+H2O=CH3COOH+2H+
C. 设电解时溶液体积不变,则阴极区Na2SO4的物质的量增大
D. 电解过程中,M 池溶液的pH 变大,N 池溶液的pH 变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积不同的HA溶液与BOH 溶液混合,保持溶液的总体积为100 mL,溶液的体积与混合液pH 的关系如图所示。下列说法正确的是

A. V1表示HA 溶液的体积,V2表示BOH 溶液的体积
B. Ka( HA) 和Kb( BOH) 的数量级相等,均为10-6
C. y点时,c(B+)=c(A-)=c(OH-)=c(H+)
D. x、y、z 所示三点时水的电离程度:y>x=z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物的化学式为[Cr(CH3COO)2]2·2H2O,该水合物通常为红棕色晶体,是一种常用的氧气吸收剂,不溶于水和乙醚(一种易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,易被氧化。已知Cr3+水溶液呈绿色,Cr2+水溶液呈蓝色。实验室制备醋酸亚铬水合物的装置如下图所示。

(1)检查装置气密性后,向左侧三颈烧瓶中依次加入过量锌粒和适量CrCl3溶液,关闭K1打开K2,旋开a的旋塞,控制好滴速。a的名称是___________,此时左侧三颈烧瓶中发生反应的化学方程式为_______、________。一段时间后,整个装置内充满氢气,将空气排出。当观察到左侧三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,关闭K2,打开K1,将左侧三颈烧瓶内生成的CrCl2溶液压入右侧三颈烧瓶中,则右侧三颈烧瓶中发生反应的离子方程式为________________________________________。
(2)本实验中所有配制溶液的水均需煮沸,其原因是______________________。右侧的烧怀内盛有水,其中水的作用是_______________________________________________。
(3)当观察到右侧三颈烧瓶内出现大量红棕色晶体时,关闭a 的旋塞。将红棕色晶体快速过滤、水洗、乙醚洗、干燥,即得到[Cr(CH3COO)2]2·2H2O。其中用乙醚洗涤产物的目的是_______________________。
(4)称量得到的[Cr(CH3COO)2]2·2H2O晶体,质量为m g,,若所取用的CrCl3溶液中含溶质n g,则[Cr(CH3COO)2]2·2H2O(M1=376 )的产率是______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)31Ga基态原子的核外电子排布式是___________。C、N、O三种元素第一电离能从大到小的顺序是____________。写出一种与 OH- 互为等电子体的分子为_________________(填化学式)。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_________;N2H4分子中氮原子轨道的杂化类型是_______。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
a. CF4 b. NH4+ c.CH4 d. H2O

(3)最近发现,只含C、Mg和Ni三种元素的某种晶体具有超导性。该晶体的一个晶胞如图3所示,则该晶体的化学式为 ___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________(至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)![]() B(l)ΔH1 O2(g)+B(l)
B(l)ΔH1 O2(g)+B(l)![]() A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)
A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)![]() H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com