
如图是模拟电化学反应装置图。下列说法正确的是( )

A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+
B.开关K置于N处,可以减缓铁的腐蚀
C.开关K置于M处,则铁电极的电极反应式为: 2Cl--2e-=Cl2↑
D.开关K置于M处,电子从碳棒经开关K流向铁棒
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2014年化学高考题型专练五 元素周期表中位-构-性关系的分析练习卷(解析版) 题型:选择题
某元素X的原子的核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )。
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:选择题
下列与有机物结构、性质相关的叙述错误的是( )
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下能水解
C.甲烷和氯气反应生成一氯甲烷,苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
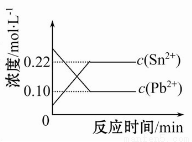
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
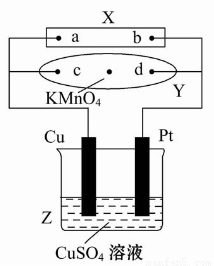
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:实验题
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
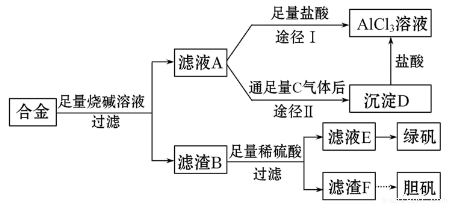
试回答下列问题:
(1)过滤用的器材已有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_______________。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是_____________。
(3)从滤液E中得到绿矾晶体的实验操作是_______________________________。
(4)写出用滤渣F制备胆矾晶体的化学方程式_____________________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理?________,理由是___________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:选择题
下列有关纯铁的叙述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在冷的浓硫酸中可以钝化
D.在潮湿空气中比生铁容易被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:选择题
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O=2LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:实验题
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
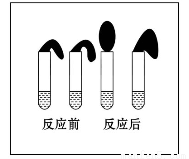
乙:① 用pH计测定浓度均为0.1 mol·L-1 的HA溶液和稀盐酸的pH;
② 再取0.1 mol·L-1的HA溶液和稀盐酸各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化。
(1)乙的方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的
pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
(填序号)
A.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入稀盐酸后,试管上方的气球鼓起慢
(2) 乙同学设计的实验第 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂(选填“A”、“B”、“C”或“D”,下同);
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 H2SO4
D.2 mol·L-1 HA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com