
【题目】某学生称取9 g淀粉溶于水,测定淀粉水解的百分率,其过程如下(已知含有醛基的有机物可在碱性条件下与银氨溶液发生银镜反应生成单质Ag):
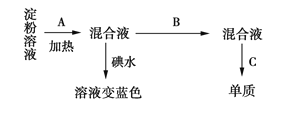
(1)填写各步所加试剂的名称:A.________;B.________;C._________。
(2)只加A而不加B是否可行?____(填“是”或“否”),理由是__________________________________。
(3)当析出2.16 g金属单质时,淀粉的水解率为___(已知1 mol醛基发生银镜反应时生成2 mol Ag)。
【答案】稀硫酸 氢氧化钠溶液 银氨溶液 否 用银氨溶液检验葡萄糖时必须在碱性条件下进行 18%
【解析】
(1)淀粉水解时用稀硫酸作催化剂,因此试剂A是稀硫酸。为检验水解产物葡萄糖,应先加入NaOH溶液中和稀硫酸,则试剂B是氢氧化钠溶液。葡萄糖与银氨溶液反应生成银单质,所以试剂C是银氨溶液。
(2)由于用银氨溶液检验葡萄糖时必须在碱性条件下进行,而淀粉水解需要用稀硫酸作催化剂,则只加A而不加B是不可行的。
(3)2.16g金属银的物质的量是![]() =0.02mol,由于1mol醛基发生银镜反应时生成2molAg,所以消耗葡萄糖的物质的量是0.01mol,则由(C6H10O5)n+nH2O
=0.02mol,由于1mol醛基发生银镜反应时生成2molAg,所以消耗葡萄糖的物质的量是0.01mol,则由(C6H10O5)n+nH2O![]() nC6H12O6可知,淀粉的水解率为
nC6H12O6可知,淀粉的水解率为
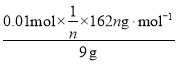 ×100%=18%。
×100%=18%。


科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
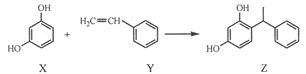
下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL﹣1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0﹣a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的Na2CO3浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是
①CH3CH(OH)COOH ②HOOCCOOH ③CH3CH2COOH ④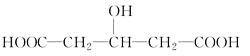
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
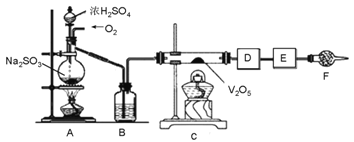
完成下列填空:
(1).A处的化学反应方程式为__________________,仪器F的名称为___________________________。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________,E:______________。

(3).用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为_____%(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
X | ||
Y | ||
Z | M |
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:![]()
![]() ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____;装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物.请回答以下问题:
⑴基态氮原子的价电子排布式是____________。
⑵肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物.
①请用价电子层对互斥理论推测NH3分子的空间构型是__________________,其中H—N—H的键角为___________________,请根据价层电子对互斥理论解释其键角小于109°28′的原因:_______。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l) +2N2H4(l)═3N2(g)+4H2O(g) △H=-1038.7kJ·mol﹣1
若该反应中有4mol N—H 键断裂,则形成π 键的数目为__________。
⑶比较氮的简单氢化物与同族第三、四周期元素所形成氢化物的沸点高低并说明理由___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com