
| A、NaHCO3溶液中存在:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
| B、室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、Na2CO3溶液:c(OH-)+c(HCO3-)=c(H+)+2c(H2CO3) |
| D、25℃时,Al(OH)3固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/LNH4Cl溶液中的Ksp小 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- |
| B、含大量Fe3+的溶液中:K+、I-、SO42-、NO3- |
| C、与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
| D、由水电离出的c(H+)=1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:X<Y |
| B、没有X元素也就没有丰富的有机世界 |
| C、非金属性Y>X,金属性W>Z |
| D、在一定条件下,利用X、Z或W单质的还原性,可以冶炼某些金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L MgCl2溶液中Cl-离子数为0.2NA |
| B、19.2g铜与足量的稀硝酸反应产生NO的体积为4.48L |
| C、标准状况下,33.6L H2O含有9.03×1023个H2O分子 |
| D、46g NO2和N2O4的混合物中原子总数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、维生素A的分子式为C20H30O |
| B、维生素A是一种易溶于水的醇 |
| C、维生素A分子中含有羟基、碳碳双键和苯环等官能团 |
| D、1mol维生素A最多可与7mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有0.9mol的硫酸参加反应 |
| B、有0.45mol的硫酸被还原 |
| C、充分反应后体系无硫酸剩余 |
| D、消耗的铜的质量一定少于28.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
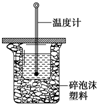 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com