
 .
.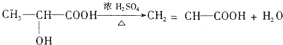 .
.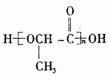 .
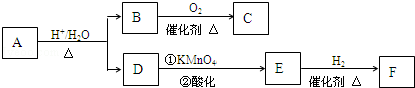
.分析 由0.5molA完全燃烧只生成3molCO2和2.5molH2O,则A分子中N(C)=$\frac{3mol}{0.5mol}$=6、N(H)=$\frac{2.5mol×2}{0.5mol}$=10,则N(O)=$\frac{130-12×6-10}{16}$=3,故A的分子式为C6H10O3,A水解得到B、D,则A含有酯基,因D的分子式为C4H6O2,则B的分子式为C2H6O2,B能发生催化氧化生成C,则B中含有羟基,由1molB与钠反应生成标况下22.4L氢气,则B为二元醇,即B为HOCH2CH2OH,B催化氧化为C,B与C的相对分子质量之差为4,则C的结构简式为:OHC-CHO.D为羧酸,不饱和度为2,能被酸性高锰酸钾氧化,故D分子中还含有1个碳碳双键,D氧化生成E,E能与氢气发生加成反应生成F,则F中含有羟基,由两分子F反应可生成含甲基的六元环状酯类化合物,则F中-COOH与-OH连接在同一碳原子上,可知F的结构简式为:CH3CH(OH)COOH,E的结构简式为:CH3COCOOH,D的结构简式为CH2=C(CH3)COOH,由B和D的结构简式,可知A的结构简式为:CH2=C(CH3)COOCH2CH2OH,据此解答.
解答 解:由0.5molA完全燃烧只生成3molCO2和2.5molH2O,则A分子中N(C)=$\frac{3mol}{0.5mol}$=6、N(H)=$\frac{2.5mol×2}{0.5mol}$=10,则N(O)=$\frac{130-12×6-10}{16}$=3,故A的分子式为C6H10O3,A水解得到B、D,则A含有酯基,因D的分子式为C4H6O2,则B的分子式为C2H6O2,B能发生催化氧化生成C,则B中含有羟基,由1molB与钠反应生成标况下22.4L氢气,则B为二元醇,即B为HOCH2CH2OH,B催化氧化为C,B与C的相对分子质量之差为4,则C的结构简式为:OHC-CHO.D为羧酸,不饱和度为2,能被酸性高锰酸钾氧化,故D分子中还含有1个碳碳双键,D氧化生成E,E能与氢气发生加成反应生成F,则F中含有羟基,由两分子F反应可生成含甲基的六元环状酯类化合物,则F中-COOH与-OH连接在同一碳原子上,可知F的结构简式为:CH3CH(OH)COOH,E的结构简式为:CH3COCOOH,D的结构简式为CH2=C(CH3)COOH,由B和D的结构简式,可知A的结构简式为:CH2=C(CH3)COOCH2CH2OH.
(1)B为乙二醇,含官能团为羟基,C的结构简式为:OHC-CHO,名称为乙二醛,C参加并有金属单质生成的化学方程式是:OHC-CHO+4Ag(NH3)2OH$→_{△}^{催化剂}$ 4Ag+H4NOOCCOONH4+6NH3+2H2O,
故答案为:羟基;乙二醛;OHC-CHO+4Ag(NH3)2OH$→_{△}^{催化剂}$ 4Ag+H4NOOCCOONH4+6NH3+2H2O;
(2)D的结构简式为:CH2=C(CH3)COOH,含官能团碳碳双键和羧基,与D具有相同官能团的同分异构体G为:CH2=CHCH2COOH、CH3CH=CHCOOH,
故答案为:CH2=CHCH2COOH、CH3CH=CHCOOH;
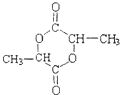
(3)①两分子F形成六元环酯,六元环状酯类化合物的结构简式是: ,故答案为:
,故答案为: ;
;
②由F可生成使 Br2的CCl4溶液褪色的有机物H,可知F发生了消去反应,反应方程式为: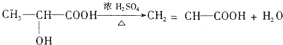 ,
,
故答案为: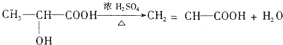 ;
;
③F含羟基和羧基,可发生缩聚反应生成聚酯,反应方程式为: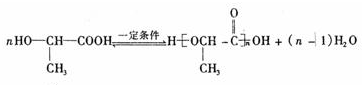 ,缩聚反应的产物的结构简式是
,缩聚反应的产物的结构简式是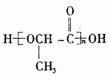 ,
,
故答案为: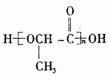 ;
;
(5)由上述分析可知,A的结构简式为:CH2=C(CH3)COOCH2CH2OH,故答案为:CH2=C(CH3)COOCH2CH2OH.
点评 本题考查了有机物的推断,注意从分子式的不同和相对分子质量的变化和反应条件来推知可能发生的反应类型,进而推出物质的结构,较好的考查学生分析推理能力,难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:多选题
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
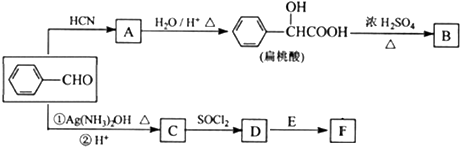

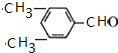
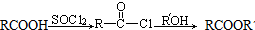 (R、Rˊ代表烃基)
(R、Rˊ代表烃基)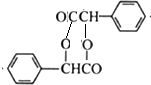 ,化合物C中的含氧官能团的名称是羧基.
,化合物C中的含氧官能团的名称是羧基. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Aɡ↓+H2O | |
| C. | 向沸水中滴加FeCl3溶液制备胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 将Cl2溶于水中:Cl2+H2O═Cl-+2H++ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com