
分析 此题实质上是分析发生的连续反应的分段情况.
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2 ①
2Na2O2+2CO2=2Na2CO3+O2 ②
2Na2O2+2H2O=4NaOH+O2 ③
当发生反应①、②且完全反应时,则有Na2CO3、H2O和O2,$\frac{a}{b}$=$\frac{1}{2}$;若Na2O2不足,则CO2有剩余,则$\frac{a}{b}$<$\frac{1}{2}$.
当发生反应①、②、③且完全反应时,a=b,$\frac{a}{b}$=1,有Na2CO3、NaOH和O2;若Na2O2不足以与水完全反应,则水蒸气有剩余,$\frac{a}{b}$<1;若Na2O2有剩余,则$\frac{a}{b}$>1,由此分析解答.
解答 解:(1)当剩余固体只有碳酸钠时,则过氧化钠恰好和二氧化碳完全反应,发生的反应方程式为2NaHCO3+Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2CO3+H2O+$\frac{1}{2}$O2,所以,$\frac{a}{b}$的值为$\frac{1}{2}$,故答案为:$\frac{1}{2}$;
(2)当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,由于有NaOH生成,所以有水与Na2O2反应.假设反应后无H2O生成,将方程式①×2+②+③得:2NaHCO3+2Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2CO3+2NaOH+O2↑,由方程式可知此时$\frac{a}{b}=1$,因为有水生成,所以$\frac{1}{2}<\frac{a}{b}<1$,故答案为:$\frac{1}{2}<\frac{a}{b}<1$;
(3)当$\frac{a}{b}>1$时,由(2)讨论可知:剩余固体为Na2CO3、NaOH、Na2O2;排出气体为O2,故答案为:当剩余固体为Na2CO3,排出气体为O2;
(4)2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2 ①
2 1 1
b $\frac{b}{2}$ $\frac{b}{2}$
2Na2O2+2CO2=2Na2CO3+O2 ②
2 2 1
$\frac{b}{2}$ $\frac{b}{2}$ $\frac{b}{4}$
2Na2O2+2H2O=4NaOH+O2 ③
2 2 1
x x $\frac{x}{2}$
排出的水为$\frac{b}{2}$-x,氧气的量为 $\frac{b}{4}+\frac{x}{2}$,当排出的O2和H2O为等物质的量时,则
$\frac{b}{2}$-x=$\frac{b}{4}+\frac{x}{2}$,x=$\frac{b}{6}$,所以a=$\frac{4b}{6}$,所以$\frac{a}{b}$=$\frac{\frac{4b}{6}}{b}$=$\frac{2}{3}$,故答案为:$\frac{2}{3}$.
点评 本题考查过氧化钠与水和二氧化碳的反应、氧化还原反应、化学计算等知识点,属于中等难度试题.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
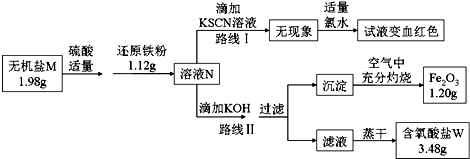
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 由沙子制备光伏材料时的反应之一为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑ | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
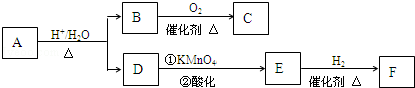
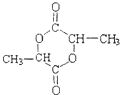 .
.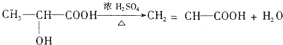 .
.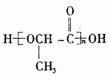 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
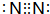 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
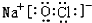
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com