
分析 (1)除去混合气体中二氧化碳和水,可以选用碱石灰;浓硫酸在该反应中表现了脱水性;
(2)①根据化合物中总化合价为0计算出优氯净 Cl2Na(NCO)3中Cl元素的化合价;
②次氯酸具有强氧化性,能够与亚硫酸根离子发生氧化还原反应;
③亚硫酸钠若变质,溶液中会存在硫酸钠,先用过量盐酸除去亚硫酸根离子,然后用氯化钡检验是否含有硫酸根离子,从而判断亚硫酸钠是否变质;根据化合价变化判断反应产物,写出反应的化学方程式;
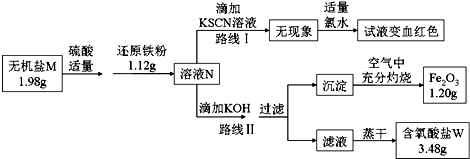
(3)1.2g氧化铁的物质的量为:$\frac{1.2g}{160g/mol}$=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为2:1:4,则M的化学式为:K2FeO4,
①路线Ⅰ为检验亚铁离子的方法;
②K2FeO4与稀硫酸、铁粉反应生成硫酸亚铁、硫酸钾和水,根据质量守恒可知W为硫酸钾;根据n=$\frac{m}{M}$计算出K2FeO4的物质的量,再根据n=nM计算出钾离子的质量;
③根据K2FeO4与稀硫酸、铁粉反应生成硫酸亚铁、硫酸钾和水写出反应的化学方程式.
解答 解:(1)硫酸是一种重要的含氧酸,实验室用浓硫酸与乙二酸(H2C2O4)晶体共热,可获得CO与CO2的混合气体,再将混合气进一步通过要得到纯净的CO气体,需要除去混合气体中二氧化碳和水,所以应该用碱石灰干燥;浓硫酸在反应中起到了脱水性,
故答案为:碱石灰(CaO或NaOH固体);脱水性;
(2)①优氯净Cl2Na(NCO)3中,钠离子的化合价为+1价,N为-3价、O为-2价、C为+4价,设Cl元素的化合价为x,则:2x+(+1)+3[(-3)+(+4)+(-2)]=0,解得:x=+1,故答案为:+1;
②亚硫酸根离子与次氯酸反应生成硫酸根离子、氯离子,反应的离子方程式为:SO32-+HClO═SO42-+Cl-+H+,故答案为:SO32-+HClO═SO42-+Cl-+H+;
③亚硫酸钠溶液在空气中易变质,则溶液中会存在硫酸根离子,所以判断亚硫酸钠溶液是否变质的方法为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质;无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体,根据化合价变化可知,另一种产物为Na2SO4,反应的化学方程式为:4Na2SO3$\frac{\underline{\;600℃\;}}{\;}$3Na2SO4+Na2S,
故答案为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质;
(3)①根据路线Ⅰ可知,N溶液中一定含有亚铁离子,故答案为:Fe2+;
②1.2g氧化铁的物质的量为:$\frac{1.2g}{160g/mol}$=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为2:1:4,则M的化学式为:K2FeO4,根据流程可知,K2FeO4与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾;
1.98gK2FeO4的物质的量为$\frac{1.98g}{198g/mol}$=0.01mol,0.01molK2FeO4中含有0.02mol钾离子,含有钾离子的质量为39g/mol×0.02mol=0.78g,
故答案为:K2SO4 ;0.78;
③无机盐M与还原铁粉反应生成硫酸亚铁、硫酸钾和水,反应的化学方程式为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O,
故答案为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O.
点评 本题考查了探究物质组成的方法,题目难度较大,试题涉及物质组成的测定、浓硫酸的性质、离子方程式、化学方程式的书写、离子的检验方法等知识,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | lmol Na2O2晶体中共含有2NA个离子 | |
| B. | 0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 电解精炼铜时每转移NA个电子,阳极生成氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物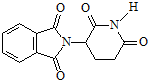 的分子式为C13H9O4N2 的分子式为C13H9O4N2 | |
| B. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| C. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| D. | 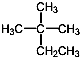 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
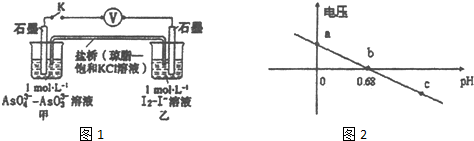
| A. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | a点时,盐桥中K+向左移动 | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐中阴离子的结构示意图为  | |
| B. | 氧化亚铁溶于足量稀硝酸的离子方程式:FeO+2H+=Fe2++H2O | |
| C. | NaHS水解的离子方程式:HS-十H20?H3O++S2- | |
| D. | 用惰性电极电解氯化钠溶液,阳极电极反应式:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com