
【题目】下列有关实验原理、装置、操作或结论的描述正确的是( )
A.图反应一段时间后试管中液面会下降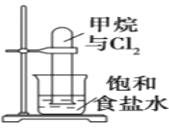
B.图装置可用于分离乙醇和乙酸乙酯的混合液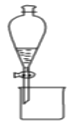
C.图装置可用于实验室制乙炔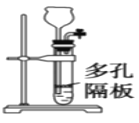
D.图教材重结晶法提纯苯甲酸的实验中,主要步骤依次为:加热溶解→趁热过滤→冷却结晶→过滤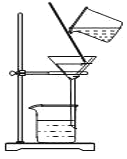
【答案】D
【解析】
A. 甲烷与氯气在光照条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,一氯甲烷和氯化氢是气体,且氯化氢极易溶于水,二氯甲烷、三氯甲烷和四氯甲烷是油状液体,所以反应一段时间后试管中液面会上升,但不会充满,A错误;
B. 乙醇和乙酸乙酯互溶,不能用简单的分液,分离乙酸乙酯和乙醇的混合物,加入饱和碳酸钠溶液,实现酯和乙醇的分离,分离油层和水层采用分液的方法即可,B错误;
C. 依据乙炔实验室制备的原理,可知制取装置为:固体+液体→气体,且固体电石易与水反应变成粉末状物质,不能控制反应的停止,不能用该装置,C错误;
D. 苯甲酸的溶解度随温度变化较大,趁热过滤可除去杂质,杂质残留在母液中,冷却可得到晶体,D正确;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种主族元素,A、B同周期相邻,A、C同主族相邻,A、B、C三种元素的原子序数之和为31,D元素与A、B、C三种元素既不同周期也不同主族,但D单质与A、B、C单质均可以反应,E是短周期主族中原子半径最大的元素,F是B同周期相邻元素。回答下列问题:
(1)写出C的元素符号:_______________ D在周期表中的位置____________________ 。
(2)B、D可直接化合生成化合物x, x分子与A、D形成的分子的稳定性比较_____________________________。(用化学式表示)
(3)A、B、D可组成离子化合物y的化学式为__________;E与C按1:1形成的化合物的电子式为____________ 。
(4)A、C形成的一种既有氧化性又有还原性的常见化合物,它对环境的影响之一是__________________________。
(5) 标准状况下9g F与A的单质完全燃烧产生的气体通入到1 L 1 mol·L-1的NaOH 溶液中,完全反应后溶液中存在的主要离子是_____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
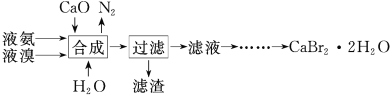
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作(装置如图):
![]()
使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,_______________。
(2)“合成”主要反应的化学方程式为__________________。“合成”温度控制在70℃以下,其原因是_________。投料时控制n(Br2)∶n(NH3)=1∶0.8,其目的是_________________。
(3)“滤渣”的主要成分为____________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,___________________。[实验中须使用的试剂:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中为实验室制取氯气及性质验证的装置图:
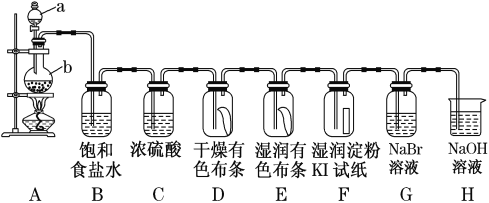
参考装置图回答下列问题:
(1)请指出仪器a的名称____________________,写出装置A中反应的化学方程式____________
(2)在装置D中可观察到的现象是________,装置E中可观察到的现象是__________。
(3)装置B的作用为_____,装置C的作用为____________,装置H的作用为_________,写出装置H中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
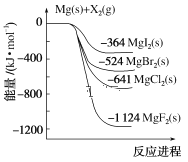
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出⑧的氢化物和②的氢化物反应的化学方程式________。
(2)在元素①~⑧中,非金属性最强的元素是________(填元素名称)。
(3)写出元素②的最高价氧化物对应水化物的电离方程式________。
(4)写出⑤⑧最高价氧化物的水化物之间的离子反应________________。
(5)由②和⑧组成的化合物中各原子均满足稳定结构,写出该化合物的结构式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是( )
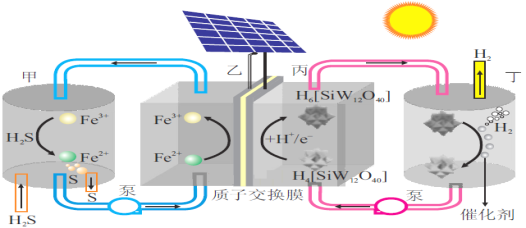
A.甲区发生反应的离子方程式为:2Fe3++S2-=2Fe2++S↓
B.理论上每生成1molS时,H+由质子交换膜右侧向左侧移动的物质的量为2mol
C.丙区发生的电极反应为:H4[SiW12O40]+2e-+2H+=H6[SiW12O40]
D.丁区H6[SiW12O40]在催化剂表面发生电化学反应生成H4[SiW12O40]和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)在水中的电离方程式为N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
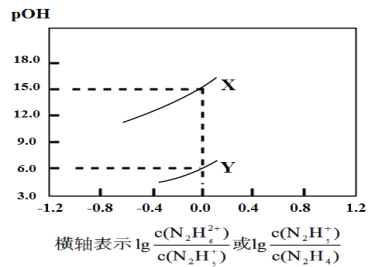
A.曲线X表示pOH与lg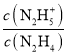 的变化关系
的变化关系
B.反应N2H62++H2O![]() N2H5++H3O+的平衡常数K=10-15
N2H5++H3O+的平衡常数K=10-15
C.联氨的溶液加水稀释时联氨的电离程度逐渐增大
D.N2H5Cl的水溶液中存在等式:c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com