
ЁОЬтФПЁПвбжЊСЊАБ(N2H4)дкЫЎжаЕФЕчРыЗНГЬЪНЮЊN2H4+H2O![]() N2H5++OH-ЃЌN2H5++H2O
N2H5++OH-ЃЌN2H5++H2O![]() N2H62++OH-ЁЃГЃЮТЯТЃЌНЋбЮЫсж№ЕЮМгЕНСЊАБЕФЫЎШмвКжаЃЌЛьКЯШмвКЕФpOH[pOH=-lgc(OH-)]ЫцРызгХЈЖШБфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
N2H62++OH-ЁЃГЃЮТЯТЃЌНЋбЮЫсж№ЕЮМгЕНСЊАБЕФЫЎШмвКжаЃЌЛьКЯШмвКЕФpOH[pOH=-lgc(OH-)]ЫцРызгХЈЖШБфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
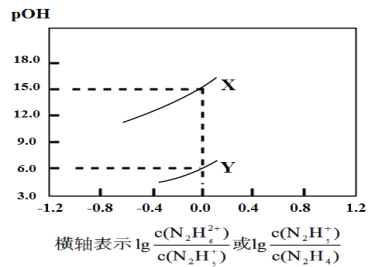
A.ЧњЯпXБэЪОpOHгыlg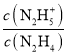 ЕФБфЛЏЙиЯЕ
ЕФБфЛЏЙиЯЕ
B.ЗДгІN2H62++H2O![]() N2H5++H3O+ЕФЦНКтГЃЪ§K=10-15
N2H5++H3O+ЕФЦНКтГЃЪ§K=10-15
C.СЊАБЕФШмвКМгЫЎЯЁЪЭЪБСЊАБЕФЕчРыГЬЖШж№НЅдіДѓ
D.N2H5ClЕФЫЎШмвКжаДцдкЕШЪНЃКc(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
ЁОД№АИЁПAB
ЁОНтЮіЁП
N2H4+H2ON2H5++OH-ЃЌN2H5++H2ON2H62++OH-ЃЌЕБlg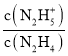 =0ЪБЃЌc(N2H4)=c(N2H5+)ЃЌKb1=
=0ЪБЃЌc(N2H4)=c(N2H5+)ЃЌKb1= =c(OH-)=10-pOHЃЌЕБlg
=c(OH-)=10-pOHЃЌЕБlg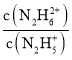 =0ЪБЃЌc(N2H5+)=c(N2H62+)ЃЌKb2=
=0ЪБЃЌc(N2H5+)=c(N2H62+)ЃЌKb2= =c(OH-)=10-pOHЃЌВЂЧвKb1>Kb2ЃЌгЩЭМПЩжЊЃЌXЕуpOH=15.0ЃЌYЕуpOH=6.0ЃЌЫљвдKb1=10-6.0ЃЌKb2=10-15.0ЃЌЧњЯпXБэЪОpOHгыlg
=c(OH-)=10-pOHЃЌВЂЧвKb1>Kb2ЃЌгЩЭМПЩжЊЃЌXЕуpOH=15.0ЃЌYЕуpOH=6.0ЃЌЫљвдKb1=10-6.0ЃЌKb2=10-15.0ЃЌЧњЯпXБэЪОpOHгыlg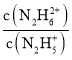 ЕФБфЛЏЙиЯЕЃЌЧњЯпYБэЪОpOHгыlg
ЕФБфЛЏЙиЯЕЃЌЧњЯпYБэЪОpOHгыlg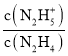 ЕФБфЛЏЙиЯЕЃЌОнДЫЗжЮіНтД№ЁЃ
ЕФБфЛЏЙиЯЕЃЌОнДЫЗжЮіНтД№ЁЃ
AЃЎгЩЗжЮіПЩжЊЃЌЧњЯпYБэЪОpOHгыlg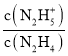 ЕФБфЛЏЙиЯЕЃЌAДэЮѓЃЛ
ЕФБфЛЏЙиЯЕЃЌAДэЮѓЃЛ
BЃЎЗДгІN2H62++H2O![]() N2H5++H3O+ЕФЦНКтГЃЪ§ЮЊ
N2H5++H3O+ЕФЦНКтГЃЪ§ЮЊ ЃЌBДэЮѓЃЛ
ЃЌBДэЮѓЃЛ
CЃЎдНЯЁдНЕчРыЃЌСЊАБЕФШмвКМгЫЎЯЁЪЭЪБЃЌСЊАБЕФЕчРыГЬЖШж№НЅдіДѓЃЌCе§ШЗЃЛ
DЃЎN2H5ClЪЧЧПЫсШѕМюбЮЃЌЫЎШмвКжаДцдкN2H5+ЕФЕчРыКЭЫЎНтЃЌЕчКЩЪиКуЃК2c(N2H62+)+c(H+)+c(N2H5+)=c(Cl-)+c(OH-)ЃЌЮяСЯЪиКуЃК
c(N2H62+)+c(N2H4)+c(N2H5+)=c(Cl-)ЃЌИљОнЮяСЯЪиКуКЭЕчКЩЪиКуЃЌЫЎШмвКжаДцдкЕШЪНЃКc(N2H62+)+c(H+)=c(N2H4)+c(OH-)ЃЌDе§ШЗЃЛ
ЙЪД№АИЮЊЃКABЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЪЕбщдРэЁЂзАжУЁЂВйзїЛђНсТлЕФУшЪіе§ШЗЕФЪЧЃЈ ЃЉ
A.ЭМЗДгІвЛЖЮЪБМфКѓЪдЙмжавКУцЛсЯТНЕ
B.ЭМзАжУПЩгУгкЗжРыввДМКЭввЫсввѕЅЕФЛьКЯвК
C.ЭМзАжУПЩгУгкЪЕбщЪвжЦввШВ
D.ЭМНЬВФжиНсОЇЗЈЬсДПБНМзЫсЕФЪЕбщжаЃЌжївЊВНжшвРДЮЮЊЃКМгШШШмНтЁњГУШШЙ§ТЫЁњРфШДНсОЇЁњЙ§ТЫ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
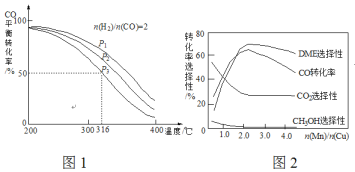
ЁОЬтФПЁПЖўМзУб(DME)БЛгўЮЊЁА21ЪРМЭЕФЧхНрШМСЯЁБЁЃгЩКЯГЩЦјжЦБИЖўМзУбЕФжївЊдРэШчЯТЃК
Ђй CO(g)+2H2(g)![]() CH3OH(g) ЁїH 1=Ѓ90.7 kJЁЄmol-1 K1
CH3OH(g) ЁїH 1=Ѓ90.7 kJЁЄmol-1 K1
Ђк 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ЁїH 2=Ѓ23.5 kJЁЄmol-1 K2
CH3OCH3(g)+H2O(g) ЁїH 2=Ѓ23.5 kJЁЄmol-1 K2
Ђл CO(g)+H2O(g)![]() CO2(g)+H2(g) ЁїH 3=Ѓ41.2kJЁЄmol-1 K3
CO2(g)+H2(g) ЁїH 3=Ѓ41.2kJЁЄmol-1 K3
ЛиД№ЯТСаЮЪЬтЃК
(1)дђЗДгІ3H2(g)ЃЋ3CO(g)![]() CH3OCH3(g)ЃЋCO2(g)ЕФЁїH=______kJЁЄmol-1ЃЌИУЗДгІЕФЦНКтГЃЪ§K=________ЃЈгУK1ЁЂK2ЁЂK3БэЪОЃЉ
CH3OCH3(g)ЃЋCO2(g)ЕФЁїH=______kJЁЄmol-1ЃЌИУЗДгІЕФЦНКтГЃЪ§K=________ЃЈгУK1ЁЂK2ЁЂK3БэЪОЃЉ
(2)ЯТСаДыЪЉжаЃЌФмЬсИп(1)жаCH3OCH3ВњТЪЕФга__________ЁЃ
A.ЪЙгУЙ§СПЕФCO B.Щ§ИпЮТЖШ C.діДѓбЙЧП
(3)вЛЖЈЮТЖШЯТЃЌ0.2molCOКЭ0.1molH2OЭЈШы2LКуШнУмБеШнЦїжаЃЌЗЂЩњЗДгІЂлЃЌ5ЗжжгЪБДяЕНЛЏбЇЦНКтЃЌЦНКтКѓВтЕУH2ЕФЬхЛ§ЗжЪ§ЮЊ0.1ЁЃдђ5Зжжгv(H2O)=_______________ЃЌCOЕФзЊЛЏТЪІС(CO)=___________ЁЃ
(4)НЋКЯГЩЦјвд![]() =2ЭЈШы1 LЕФЗДгІЦїжаЃЌвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃК4H2(g)+2CO(g)
=2ЭЈШы1 LЕФЗДгІЦїжаЃЌвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃК4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ЁїHЃЌЦфCOЕФЦНКтзЊЛЏТЪЫцЮТЖШЁЂбЙЧПБфЛЏЙиЯЕШчЭМ1ЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ___________ЁЃ
CH3OCH3(g)+H2O(g) ЁїHЃЌЦфCOЕФЦНКтзЊЛЏТЪЫцЮТЖШЁЂбЙЧПБфЛЏЙиЯЕШчЭМ1ЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ___________ЁЃ
A.ЁїH <0 B.P1>P2>P3
C.ШєдкP3КЭ316ЁцЪБЃЌЦ№ЪМЪБ![]() =3ЃЌдђЦНКтЪБЃЌІС(CO)аЁгк50ЃЅ
=3ЃЌдђЦНКтЪБЃЌІС(CO)аЁгк50ЃЅ
(5)ВЩгУвЛжжаТаЭЕФДпЛЏМС(жївЊГЩЗжЪЧCu-MnЕФКЯН№)ЃЌРћгУCOКЭH2жЦБИЖўМзУбЃЈDMEЃЉЁЃЙлВьЭМ2ЛиД№ЮЪЬтЁЃДпЛЏМСжа![]() дМЮЊ___________ЪБзюгаРћгкЖўМзУбЕФКЯГЩЁЃ
дМЮЊ___________ЪБзюгаРћгкЖўМзУбЕФКЯГЩЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃК2Fe2++Br2=2Fe3++2Br-ЃЌ2Fe3++2I-=2Fe2++I2ЁЃЯђFeI2ЁЂFeBr2ЕФЛьКЯШмвКжаЭЈШыЪЪСПCl2ЃЌШмвКжаФГаЉРызгЕФЮяжЪЕФСПБфЛЏШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
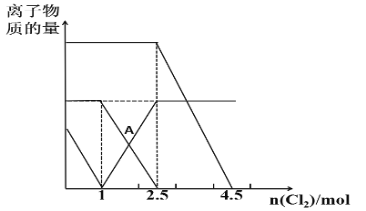
A.Ш§жжРызгЕФЛЙдадЧПШѕЙиЯЕЪЧЃКBr->Fe2+>I-
B.AЕуБэЪОFe2+е§КУЗДгІСЫвЛАы
C.дШмвКжаЃКn(Fe2+)ЉUn(I-)ЉUn(Br-)=2ЉU1ЉU3
D.ЕБЭЈШы2.5molCl2ЪБЃЌШмвКжавбЗЂЩњЕФРызгЗДгІПЩБэЪОЮЊЃК6Fe2++4I-+5Cl2=6Fe3++2I2+10Cl-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчЩјЮіЗЈЪЧКЃЫЎЕЛЏЕФГЃгУЗНЗЈЃЌФГЕиКЃЫЎжажївЊРызгЕФКЌСПШчЯТБэЃЌЯжРћгУЁАЕчЩјЮіЗЈЁБНјааЕЛЏЃЌММЪѕдРэШчЭМЫљЪОЃЈСНЖЫЮЊЖшадЕчМЋЃЌбєФЄжЛдЪаэбєРызгЭЈЙ§ЃЌвѕФЄжЛдЪаэвѕРызгЭЈЙ§ЃЉЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
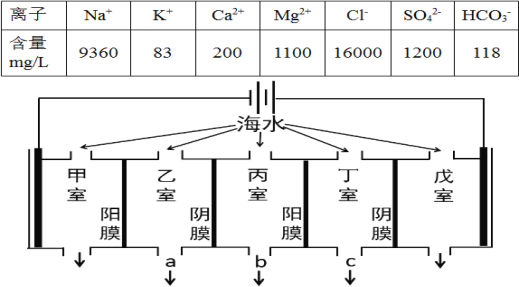
A.ЕЛЏЙ§ГЬжавздкМзЪваЮГЩЫЎЙИ
B.ЕЛЏЙ§ГЬжаЮьЪвЕФЕчМЋЗДгІЪНЮЊЃК2Cl--2e-=Cl2Ёќ
C.ЕЛЏЙ§ГЬжаввЪвКЭЖЁЪвжаВПЗжРызгЕФХЈЖШМѕаЁЃЌЕЫЎЕФГіПкЮЊaЁЂc
D.ЕБМзЪвЪеМЏЕНБъзМзДПіЯТ11.2LЦјЬхЪБЃЌЭЈЙ§МзЪвбєФЄЕФРызгЕФЮяжЪЕФСПвЛЖЈЮЊ1mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЯђ10mL0.1mol/LNa2CO3ШмвКжаж№ЕЮМгШы20mL0.1mol/LЕФбЮЫсЃЌШмвКжаВПЗжКЌЬМЮЂСЃЕФЮяжЪЕФСПЫцШмвКpHЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
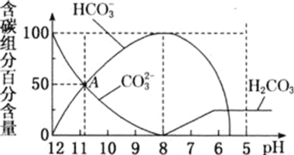
A.HClШмвКЕЮМгвЛАыМД10mLЪБЃЌШмвКpH>7
B.0.1mol/LNa2CO3ШмвКжаc(Na+)+c(H+)ЃНc(OH-)+2c(CO32-)+c(HCO3-)
C.дкAЕуЃКc(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.ЕБpH=5ЪБЃЌШмвКжаc(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП![]() ЪБЃЌЯТСаИїШмвКжагаЙиЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕе§ШЗЕФЪЧ
ЪБЃЌЯТСаИїШмвКжагаЙиЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕе§ШЗЕФЪЧ![]()
![]()
A.Яђ![]() ШмвКжаЕЮМгNaOHШмвКжСЧЁКУГЪжаадЃК
ШмвКжаЕЮМгNaOHШмвКжСЧЁКУГЪжаадЃК![]()
B.![]() ШмвКГЪЫсадЃК
ШмвКГЪЫсадЃК![]()
C.![]() ШмвКгы
ШмвКгы![]() ШмвКЛьКЯКѓЕФЫсадШмвКЃК
ШмвКЛьКЯКѓЕФЫсадШмвКЃК![]() COO
COO![]()
D.ХЈЖШОљЮЊ![]() ЕФаЁЫеДђШмвКгыЩеМюШмвКЕШЬхЛ§ЛьКЯЃК
ЕФаЁЫеДђШмвКгыЩеМюШмвКЕШЬхЛ§ЛьКЯЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃЎвбжЊЃЌГЃЮТЯТH2SЁЂH2CO3ЕФЕчРыГЃЪ§ШчБэ
Ka1 | Ka2 | |
H2S | 9.1ЁС10-8 | 1ЁС10-15 |
H2CO3 | 4.3ЁС10Ѓ7 | 5.6ЁС10Ѓ11 |
(1)ЂйГЃЮТЯТЃЌ0.1 molЁЄL-1ЕФСђЛЏФЦШмвККЭ0.1molЁЄL-1ЕФЬМЫсФЦШмвКЃЌМюадИќЧПЕФЪЧ_______ЁЃЦфдвђЪЧ_____________________________ЁЃ
ЂкГЃЮТЯТЃЌСђЛЏФЦЫЎНтЕФРызгЗНГЬЪНЮЊ_____________________________ЁЃ
(2)ГЃЮТЯТЃЌЯђ100mL0.1molЁЄLЃ1H2SШмвКжаЕЮМг0.1molЁЄLЃ1NaOHШмвКЃЌЕУЕНШмвКpHгыNaOHШмвКЬхЛ§ЕФЙиЯЕЧњЯпШчЭМЫљЪОЃК

ЪдЗжЮіЭМжаaЁЂbЁЂcЁЂdЫФИіЕуЃЌЫЎЕФЕчРыГЬЖШзюДѓЕФЪЧ________ЁЃ
IIЃЎМѕЩйNO2ЁЂSO2ЁЂCOЕШгаКІЦјЬхЖдДѓЦјЛЗОГЕФЮЃКІЃЌЪЧШЫРрЕФЙВЭЌзЗЧѓЁЃ
(3)вдМзДМзіШМСЯЕФЕчГиЃЌШчЭМЫљЪОЃЌЦфИКМЋЗДгІЪНЮЊ________ЃЌИУШМСЯЕчГидкРэЯызДЬЌЯТЃЌНЋга96.5%ЕФЛЏбЇФмзЊЛЏГЩЕчФмЃЌМДЯћКФ1molвКЬхМзДМЫљФмВњЩњЕФзюДѓЕчФмДя702.1kJЃЌдђЭЈГЃМзДМШМЩеЕФШШЛЏбЇЗДгІЗНГЬЪНЮЊ________ЁЃ

(4)вбжЊЃКNO2(g)+SO2(g)![]() SO3(g)+NO(g) ЁїH=+41.8kJmolЉ1ЁЃвЛЖЈЬѕМўЯТЃЌНЋNO2гыSO2вдЬхЛ§БШ1ЃК2жУгкУмБеШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌЯТСаФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЕФ________ЁЃ
SO3(g)+NO(g) ЁїH=+41.8kJmolЉ1ЁЃвЛЖЈЬѕМўЯТЃЌНЋNO2гыSO2вдЬхЛ§БШ1ЃК2жУгкУмБеШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌЯТСаФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЕФ________ЁЃ
aЃЎЬхЯЕбЙЧПБЃГжВЛБф bЃЎЛьКЯЦјЬхбеЩЋБЃГжВЛБф
cЃЎSO3КЭNOЕФЬхЛ§БШБЃГжВЛБф dЃЎУПЯћКФ1molSO3ЕФЭЌЪБЩњГЩ1molNO2
(5)ЕБЩЯЪіЗДгІЦНКтЪБЃЌВтЕУNO2гыSO2ЬхЛ§БШЮЊ1ЃК6ЃЌдђЦНКтГЃЪ§K=________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГгаЛњЮяПЩЗЂЩњЯТСаБфЛЏ

вбжЊCЮЊєШЫсЃЌЧвCЁЂEОљВЛЗЂЩњвјОЕЗДгІЃЌдђAЕФПЩФмНсЙЙга
A.1жжB.2жжC.3жжD.4жж
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com