
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
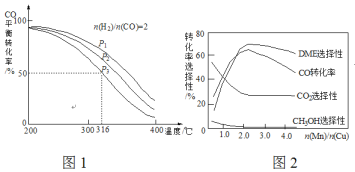
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。
【答案】-246.1 K12·K2·K3 AC 0.003 15 % AB 2.0(2-3之间即可)
【解析】
(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;根据盖斯定律,将已知的热化学方程式叠加,可得到待求的反应的热化学方程式及其反应热;
(2)提高CH3OCH3产率,改变条件应使平衡正向移动,结合平衡移动原理分析解答;
(3)根据物质转化关系,结合平衡时H2的含量,计算反应消耗的H2O、CO的物质的量,然后根据物质反应速率和转化率的含义计算;
(4)A.根据压强一定时,随温度升高CO的转化率减小判断反应的热效应;
B.根据温度不变时CO的转化率遇压强的关系判断几个反应的压强大小;
C.增大氢气的用量,平衡正向移动,CO的转化率增大;
(5)CO的转化率最大,生成二甲醚的选择性最大时最好。
(1)①CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
根据盖斯定律,①×2+②+③得3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=-246.1kJ/mol;该反应是①×2+②+③叠加而来,根据化学平衡常数的含义可知K= K12·K2·K3;
CH3OCH3(g)+CO2(g) △H=-246.1kJ/mol;该反应是①×2+②+③叠加而来,根据化学平衡常数的含义可知K= K12·K2·K3;
(2)A.增大反应物的浓度平衡正移,更多的CH3OCH3生成,能提高CH3OCH3产率,A正确;
B.该反应的正反应为放热反应,升高温度平衡逆向移动,则CH3OCH3产率会降低,B错误;
C.该反应正方向为气体体积减小的方向,所以增大压强平衡正移,能提高CH3OCH3产率,C正确;
故合理选项是AC;
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③CO(g)+H2O(g)![]() CO2(g)+H2(g),5分钟时达到化学平衡,假设反应的CO的物质的量为x,则平衡时各种气体物质的量分别是n(CO)=(0.2-x)mol,n(H2O)=(0.01-x)mol,n(H2)=n(CO2)=xmol,由于该反应是反应前后气体体积相等的反应,所以平衡后混合气体的物质的量n(总)=0.2mol+0.1mol=0.3mol,测得H2的体积分数为0.1,则n(H2)=0.1×(0.2+0.1)mol=0.03mol,则5分钟 时△n(H2O)=△n(CO)=0.03mol,所以v(H2O)=
CO2(g)+H2(g),5分钟时达到化学平衡,假设反应的CO的物质的量为x,则平衡时各种气体物质的量分别是n(CO)=(0.2-x)mol,n(H2O)=(0.01-x)mol,n(H2)=n(CO2)=xmol,由于该反应是反应前后气体体积相等的反应,所以平衡后混合气体的物质的量n(总)=0.2mol+0.1mol=0.3mol,测得H2的体积分数为0.1,则n(H2)=0.1×(0.2+0.1)mol=0.03mol,则5分钟 时△n(H2O)=△n(CO)=0.03mol,所以v(H2O)=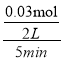 =0.003mol/(Lmin),CO的转化率α(CO)=
=0.003mol/(Lmin),CO的转化率α(CO)=![]() ×100%=15%;
×100%=15%;
(4)A.由图可知,压强一定时,随温度升高CO的转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,A正确;
B.正反应为气体体积减小的反应,增大压强平衡正向移动,CO的转化率增大,所以P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时![]() =3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,C错误;
=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,C错误;
故合理选项是AB;
(5)由图可知当催化剂中![]() 约为2.0时,CO的转化率最大,生成二甲醚的最多。
约为2.0时,CO的转化率最大,生成二甲醚的最多。


科目:高中化学 来源: 题型:
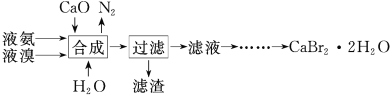
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作(装置如图):
![]()
使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,_______________。
(2)“合成”主要反应的化学方程式为__________________。“合成”温度控制在70℃以下,其原因是_________。投料时控制n(Br2)∶n(NH3)=1∶0.8,其目的是_________________。
(3)“滤渣”的主要成分为____________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,___________________。[实验中须使用的试剂:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出⑧的氢化物和②的氢化物反应的化学方程式________。
(2)在元素①~⑧中,非金属性最强的元素是________(填元素名称)。
(3)写出元素②的最高价氧化物对应水化物的电离方程式________。
(4)写出⑤⑧最高价氧化物的水化物之间的离子反应________________。
(5)由②和⑧组成的化合物中各原子均满足稳定结构,写出该化合物的结构式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是( )
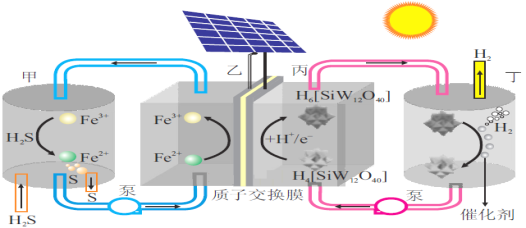
A.甲区发生反应的离子方程式为:2Fe3++S2-=2Fe2++S↓
B.理论上每生成1molS时,H+由质子交换膜右侧向左侧移动的物质的量为2mol
C.丙区发生的电极反应为:H4[SiW12O40]+2e-+2H+=H6[SiW12O40]
D.丁区H6[SiW12O40]在催化剂表面发生电化学反应生成H4[SiW12O40]和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
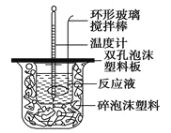
(1)烧杯间填满碎泡沫塑料的作用是______________;
(2)环形玻璃搅拌棒_______(填“能”或“不能”)用环形铁质搅拌棒代替,其原因是________;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:________。
Ⅱ.FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应2XY(g)![]() X2(g)+Y2(g) 达到平衡的标志是
X2(g)+Y2(g) 达到平衡的标志是
A. 单位时间内,生成nmolX2的同时,生成nmolXY
B. 单位时间内, 生成nmolX2的同时,生成nmolY2
C. 单位时间内,生成2nmolXY的同时,消耗nmolY2
D. 单位时间内,生成nmolX2的同时,消耗nmolY2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)在水中的电离方程式为N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
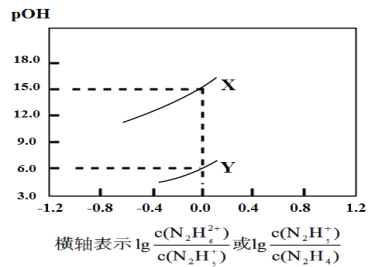
A.曲线X表示pOH与lg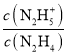 的变化关系
的变化关系
B.反应N2H62++H2O![]() N2H5++H3O+的平衡常数K=10-15
N2H5++H3O+的平衡常数K=10-15
C.联氨的溶液加水稀释时联氨的电离程度逐渐增大
D.N2H5Cl的水溶液中存在等式:c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
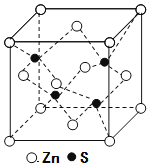
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com