
【题目】I.已知,常温下H2S、H2CO3的电离常数如表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1 mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
②常温下,硫化钠水解的离子方程式为_____________________________。
(2)常温下,向100mL0.1mol·L-1H2S溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________。
II.减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(3)以甲醇做燃料的电池,如图所示,其负极反应式为________,该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为________。

(4)已知:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
(5)当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=________。
【答案】硫化钠溶液 硫化氢的Ka2小于碳酸的Ka2,硫化钠更易水解 S2-+H2O![]() HS-+OH(主)、HS-+H2O
HS-+OH(主)、HS-+H2O![]() H2S+OH-(次) c CH3OH﹣6e-+H2O=CO2↑+6H+ CH3OH(l)+
H2S+OH-(次) c CH3OH﹣6e-+H2O=CO2↑+6H+ CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol b
O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol b ![]()
【解析】
(1)①H2S的Ka2=1×10-15,而H2CO3的Ka2=5.6×10-11,则H2S的第二步电离程度小,S2-的水解程度大,碱性更强的是硫化钠溶液。其原因是硫化氢的Ka2小于碳酸的Ka2,硫化钠更易水解。答案为:硫化钠溶液;硫化氢的Ka2小于碳酸的Ka2,硫化钠更易水解;
②H2S为弱酸,电离分步进行,则硫化钠水解也分步进行,离子方程式为S2-+H2O![]() HS-+OH(主)、HS-+H2O
HS-+OH(主)、HS-+H2O![]() H2S+OH-(次)。答案为:S2-+H2O
H2S+OH-(次)。答案为:S2-+H2O![]() HS-+OH(主)、HS-+H2O
HS-+OH(主)、HS-+H2O![]() H2S+OH-(次);
H2S+OH-(次);
(2) S2-的水解程度大于HS-,对水电离的促进作用也是S2-大于HS-,H2S与NaOH完全反应生成Na2S的点,就是水电离程度最大的点。从图中可以看出,c点应是完全反应生成Na2S的点,所以水的电离程度最大的是c。答案为:c;
(3)从图中可以看出,a电极通入O2为正极,则b电极为负极。在负极,CH3OH失电子的产物与酸性电解质反应生成CO2等,负极反应式为CH3OH﹣6e-+H2O=CO2↑+6H+,该燃料电池中,1mol甲醇燃烧理论上放热![]() kJ=727.6kJ,热化学反应方程式为CH3OH(l)+
kJ=727.6kJ,热化学反应方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol。答案为:CH3OH﹣6e-+H2O=CO2↑+6H+;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol。答案为:CH3OH﹣6e-+H2O=CO2↑+6H+;CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol;
(4) a.因为反应前后气体的分子数相等,体系压强保持不变,所以压强不变时,反应不一定达平衡状态,a不合题意;
b.混合气体颜色保持不变,表明c(NO2)不变,则反应达平衡状态,b符合题意;
c.由反应方程式知,SO3和NO的体积比始终保持不变,所以体积比不变时,反应不一定达平衡状态,c不合题意;
d.每消耗1molSO3的同时生成1molNO2,反应进行的方向相同,反应不一定达平衡状态,d不合题意;
故选b。答案为:b;
(5)令起始时c(NO2)=1mol/L,则c(SO2)=2mol/L,设c(NO2)=x mol/L,则三段式为:
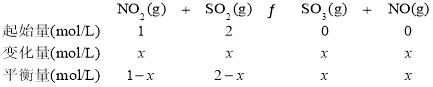
依题意,![]() ,x=0.8,K=
,x=0.8,K=![]() =
=![]() 。答案为:
。答案为:![]() 。
。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是( )
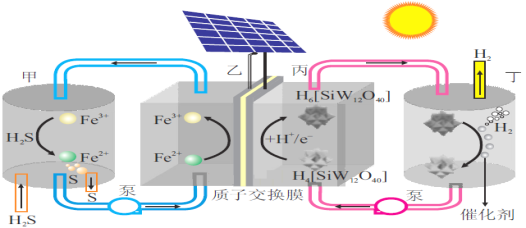
A.甲区发生反应的离子方程式为:2Fe3++S2-=2Fe2++S↓
B.理论上每生成1molS时,H+由质子交换膜右侧向左侧移动的物质的量为2mol
C.丙区发生的电极反应为:H4[SiW12O40]+2e-+2H+=H6[SiW12O40]
D.丁区H6[SiW12O40]在催化剂表面发生电化学反应生成H4[SiW12O40]和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)在水中的电离方程式为N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
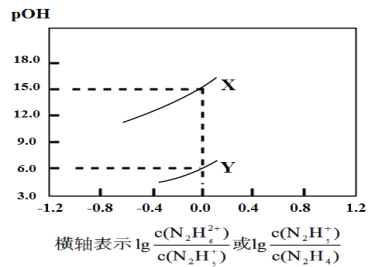
A.曲线X表示pOH与lg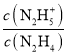 的变化关系
的变化关系
B.反应N2H62++H2O![]() N2H5++H3O+的平衡常数K=10-15
N2H5++H3O+的平衡常数K=10-15
C.联氨的溶液加水稀释时联氨的电离程度逐渐增大
D.N2H5Cl的水溶液中存在等式:c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.食醋除水垢:![]()
B.稀硝酸中加入少量亚硫酸钠:![]()
C.处理工业废水时Cr(Ⅵ)的转化:![]()
D.用酸性KMnO4测定草酸溶液浓度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH-![]() 8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
A. 通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?____________________________________________。
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是________,BaSO4的溶解度的大小顺序为______________
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为 ______________,溶液②中c(Ba2+)为 __________________。
(4)取溶液③和溶液④直接混合,则混合溶液的pH为 __________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
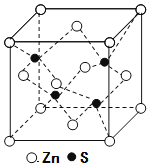
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)被氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。回答下列问题:

(1)图中A、C分别表示:________、________。
(2)图中ΔH=___kJ·mol-1。
(3)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH 并写出其热化学反应方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2不能全部转化达为SO3
2SO3反应中,SO2不能全部转化达为SO3
D. 实验室用碳酸钙和盐酸反应制取CO2,若将块状碳酸钙粉碎,会加快反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com