
【题目】25℃时,向10mL0.1mol/LNa2CO3溶液中逐滴加入20mL0.1mol/L的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
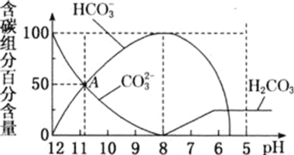
A.HCl溶液滴加一半即10mL时,溶液pH>7
B.0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C.在A点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.当pH=5时,溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
【答案】D
【解析】
A.HCl溶液滴加一半时,碳酸钠与盐酸刚好完全反应生成碳酸氢钠和氯化钠,碳酸氢钠水解溶液呈碱性,混合液的pH>7,A正确;
B.Na2CO3溶液中存在的电荷守恒为c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),B正确;
C.在A点,n(CO32-)=n(HCO3-)=0.0005mol时,得到等物质的量浓度的碳酸钠和碳酸氢钠,两者水解溶液呈碱性,所以离子浓度关系为c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),C正确;
D.碳酸钠溶液中满足物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),由于有CO2生成,所以c(Na+)>2c(CO32-)+2c(HCO3-)+2c(H2CO3),D错误;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
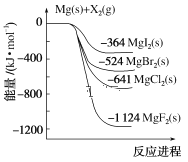
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.少量苯酚与浓溴水的反应:![]() +3Br2
+3Br2![]()
 ↓+3HBr
↓+3HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)在水中的电离方程式为N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
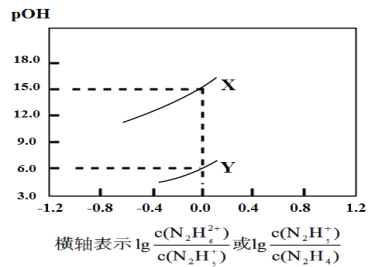
A.曲线X表示pOH与lg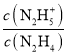 的变化关系
的变化关系
B.反应N2H62++H2O![]() N2H5++H3O+的平衡常数K=10-15
N2H5++H3O+的平衡常数K=10-15
C.联氨的溶液加水稀释时联氨的电离程度逐渐增大
D.N2H5Cl的水溶液中存在等式:c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
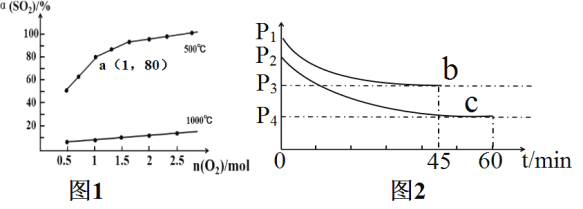
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.食醋除水垢:![]()
B.稀硝酸中加入少量亚硫酸钠:![]()
C.处理工业废水时Cr(Ⅵ)的转化:![]()
D.用酸性KMnO4测定草酸溶液浓度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?____________________________________________。
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是________,BaSO4的溶解度的大小顺序为______________
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为 ______________,溶液②中c(Ba2+)为 __________________。
(4)取溶液③和溶液④直接混合,则混合溶液的pH为 __________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1)一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率____(填“增大”、“减小”或“不变”),其原因是阳极生成强氧化性气体,则阳极电极反应为_______。

(3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH4+转化为MgNH4PO4·6H2O沉淀除去。25 ℃时,在氨氮初始质量浓度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图所示。
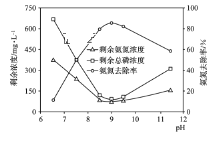
①反应生成MgNH4PO4·6H2O沉淀的离子方程式为______________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH>9时,溶液中总磷浓度随pH增大而增大的主要原因是_________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com