
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如图所示,下列说法正确的是( )
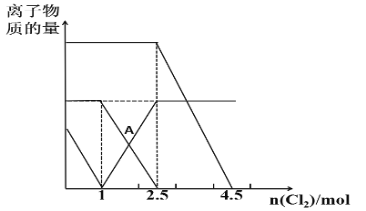
A.三种离子的还原性强弱关系是:Br->Fe2+>I-
B.A点表示Fe2+正好反应了一半
C.原溶液中:n(Fe2+)︰n(I-)︰n(Br-)=2︰1︰3
D.当通入2.5molCl2时,溶液中已发生的离子反应可表示为:6Fe2++4I-+5Cl2=6Fe3++2I2+10Cl-
【答案】BD
【解析】
首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象,判断参加反应的各离子的物质的量,以此解答该题。
A. 在2Fe2++Br2=2Fe3++2Br-反应中,Fe2+作还原剂,还原剂的还原性>还原产物的还原性,,在2Fe3++2I-=2Fe2++I2反应中,I-作还原剂,根据还原剂的还原性>还原产物的还原性,则还原性:I->Fe2+>Br-,A错误;
B. 在通入氯气的量为0~1mol的过程中,I-先被氧化;通入氯气的量为1~2.5mol的过程中,Fe2+被氧化,Fe3+的量逐渐增大,同时Fe3+与I-反应生成Fe2+和I2,A点表示Fe2+正好反应了一半,B正确;
C. 通入氯气的量为0~1mol的过程中,I-先被氧化,发生2I-+Cl2=I2+2Cl-,则n(I-)=2mol,通入氯气的量为1~2.5mol的过程中,Fe2+被氧化,2Fe2++Cl2=2Fe3++2Cl-,n(Fe2+)=3mol,
通入氯气的量为2.5~4.5mol的过程中,Br-被氧化,2Br-+Cl2= Br2+2Cl-,n(Br-)=4mol,所以n(Fe2+)︰n(I-)︰n(Br-)=3︰2︰4,C错误;
D. 当通入2.5molCl2时,溶液中已经发生:2I-+Cl2=I2+2Cl-、2Fe2++Cl2=2Fe3++2Cl-和2Fe3++2I-=2Fe2++I2,可表示为:6Fe2++4I-+5Cl2=
6Fe3++2I2+10Cl-,D正确;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是( )
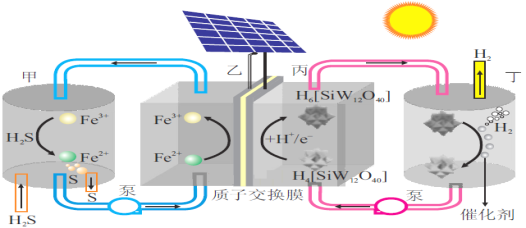
A.甲区发生反应的离子方程式为:2Fe3++S2-=2Fe2++S↓
B.理论上每生成1molS时,H+由质子交换膜右侧向左侧移动的物质的量为2mol
C.丙区发生的电极反应为:H4[SiW12O40]+2e-+2H+=H6[SiW12O40]
D.丁区H6[SiW12O40]在催化剂表面发生电化学反应生成H4[SiW12O40]和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应2XY(g)![]() X2(g)+Y2(g) 达到平衡的标志是
X2(g)+Y2(g) 达到平衡的标志是
A. 单位时间内,生成nmolX2的同时,生成nmolXY
B. 单位时间内, 生成nmolX2的同时,生成nmolY2
C. 单位时间内,生成2nmolXY的同时,消耗nmolY2
D. 单位时间内,生成nmolX2的同时,消耗nmolY2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.少量苯酚与浓溴水的反应:![]() +3Br2
+3Br2![]()
 ↓+3HBr
↓+3HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知联氨(N2H4)在水中的电离方程式为N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
N2H62++OH-。常温下,将盐酸逐滴加到联氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是( )
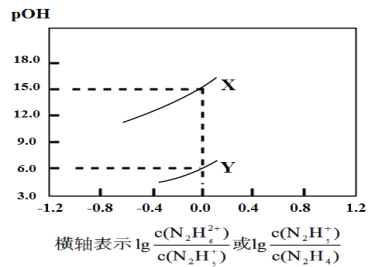
A.曲线X表示pOH与lg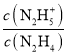 的变化关系
的变化关系
B.反应N2H62++H2O![]() N2H5++H3O+的平衡常数K=10-15
N2H5++H3O+的平衡常数K=10-15
C.联氨的溶液加水稀释时联氨的电离程度逐渐增大
D.N2H5Cl的水溶液中存在等式:c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.食醋除水垢:![]()
B.稀硝酸中加入少量亚硫酸钠:![]()
C.处理工业废水时Cr(Ⅵ)的转化:![]()
D.用酸性KMnO4测定草酸溶液浓度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)被氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。回答下列问题:

(1)图中A、C分别表示:________、________。
(2)图中ΔH=___kJ·mol-1。
(3)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH 并写出其热化学反应方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com