
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):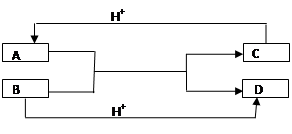
(1) 如果A、B、C、D均是10电子的粒子,请写出A、D的化学式:
A____________ D_______________
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
① A与B在溶液中反应的离子方程式为:___________________________________
② 根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_________________________________________________。
(1)A :NH4+ D :H2O
(2)① HS-+OH-=S2-+H2O (或H2S+2OH-=S2-+2H2O)
② OH->HS- (或OH- >S2-)
解析试题分析:(1)如果A、B、C、D均是10电子的粒子,结合10电子微粒进行分析判断;10电子微粒:
一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+ ;二核:HF、OH-;三核:H2O、NH2-;四核:NH3、H3O+ ;
五核:CH4、NH4+。根据发生反应A+B=C+D,A、B、C、D均是10电子的粒子,可判断为:A、B分别为OH-、NH4+,C、D分别为NH3、H2O。又因为B和氢离子反应生成D,所以B是OH-,D是水,A是NH4+,C是氨气。氨气和氢离子反应生成NH4+。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,则根据反应式A+B=C+D可知,符合条件是HS-+OH-=S2-+H2O或H2S+2OH-=S2-+2H2O。又因为B和氢离子反应生成D,所以B是OH-,D是水,A是HS-或H2S,C是S2-。
① A与B在溶液中反应的离子方程式为HS-+OH-=S2-+H2O (或H2S+2OH-=S2-+2H2O)
②根据方程式HS-+OH-=S2-+H2O (或H2S+2OH-=S2-+2H2O)可知,C与B结合质子的能力大小是OH->HS- (或OH->S2-)。
考点:考查无机框图题和10电子以及18电子微粒的判断
点评:该题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑思维能力和发散思维能力。本题主要是考查原子核外电子结构特征,物质转化关系的应用,主要是10电子和18电子微粒的分析和应用。熟练掌握常见10电子和18电子微粒是解题关键。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:单选题
在基态多电子原子中,关于核外电子能量的叙述错误的是
| A.最易失去的电子能量最高 |
| B.电离能最小的电子能量最高 |
| C.p轨道电子能量一定高于s轨道电子能量 |
| D.在离核最近区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料;⑥2M+N="2P+2Q" ,2P+M= Q
(M、N为原料,Q为期望产品),其中符合“化学反应的绿色化”的要求的是
| A.①③④⑤ | B.②③⑤⑥ | C.①②③④ | D.②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(共15分)
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______ ,
写出气体甲的电子式________ 。
(2)X的化学式是____ ,在惰性气流中加热X至完全分解的化学方程式为_______________ 。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________ 。
(用化学方程式表示)。
(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________________________________________________,
并设计实验方案验证该反应的产物_________________________________________
。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。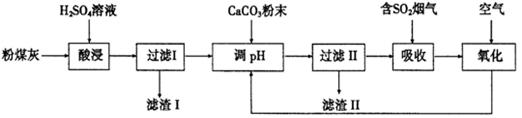
(1)酸浸时反应的化学方程式为 ;滤渣I的主要成分为 (填化学式)。
(2)滤渣Ⅱ的主要成分为 (填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为 。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为 ;氧化后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
(1)X原子的电子排布式为 。
(2)电负性:X Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。 有关Z2H4分子的说法正确的是 (填字母)。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.Z原子的杂化方式为sp2
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构如图所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围 (填数字)个氧离子相紧邻。
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55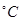 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)已知A为某种聚甲基丙烯酸酯纤维(M)的单体,其转化关系如下:
回答下列问题:
(1)B中官能团的结构简式为 ;C的名称_____________________(系统命名法命名)
(2)反应A→M的反应类型为 ;M的结构简式为 。
(3)①反应C→D的化学方程式为 。
②F与银氨溶液反应的离子方程式为 。
(4)关于E的下列说法正确的是 (填写序号)。
①分子中所有碳原子都在同一平面上 ②能与H2反应
③能与NaOH醇溶液反应 ④能与HBr反应
(5)写出满足下列条件的A的同分异构体的结构简式: 。
①与A具有相同的官能团 ②水解产物之一(式量为108)遇FeCl3溶液显紫色
③核磁共振氢谱有5种峰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com