
(12分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。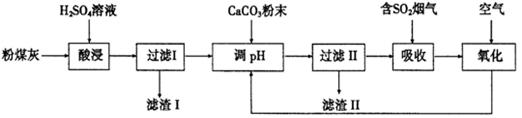
(1)酸浸时反应的化学方程式为 ;滤渣I的主要成分为 (填化学式)。
(2)滤渣Ⅱ的主要成分为 (填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为 。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为 ;氧化后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
(1)Al2O3+3H2SO4=Al2(SO4)3+3H2O;SiO2;
(2)CaSO4·2H2O或CaSO4;2 Al2(SO4)3+3CaCO3+6H2O= Al2(SO4)3·Al2O3+3CaSO4·2H2O+CO2↑:
或2Al2(SO4)3+3 CaSO4= Al2(SO4)3·Al2O3+3CaSO4+CO2↑;
(3)2 Al2(SO4)3·2Al2(SO3)3+3O2= 4Al2(SO4)3或2Al2(SO3)3+3O2= 2Al2(SO4)3;减小;
解析试题分析:(1)酸浸时含Al2O3与硫酸发生复分解反应,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;SiO2等不能与酸反应,所以滤渣I的主要成分是SiO2;(2)在滤液中含有过量的硫酸和硫酸铝,当向其中加入CaCO3时,会发生复分解反应:CaCO3+H2SO4= CaSO3+ CO2↑+ H2O;由于硫酸钙微溶于水,所以滤渣Ⅱ的主要成分为CaSO4或写为石膏CaSO4·2H2O;制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为2Al2(SO4)3+3CaCO3+6H2O= Al2(SO4)3·Al2O3+3CaSO4·2H2O+CO2↑: 或2Al2(SO4)3+3 CaSO4= Al2(SO4)3·Al2O3+3CaSO4+CO2↑;(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,空气中的氧气能够把Al2(SO3)3氧化为Al(SO4)3·发生反应的化学方程式为2 Al2(SO4)3·2Al2(SO3)3+3O2= 4Al2(SO4)3或2Al2(SO3)3+3O2= 2Al2(SO4)3;氧化后循环利用的溶液由弱酸弱碱盐变为强酸弱碱盐,所以溶液的酸性增强,故溶液的pH将减小。
考点:考查物质的性质及转化的方程式表示、盐的水解的知识。


科目:高中化学 来源: 题型:单选题
随着科学技术的不断进步,制备、研究物质的手段和途径越来越先进,H3、O4、C60、N 等相继被发现。下列有关说法中,正确的是
等相继被发现。下列有关说法中,正确的是
| A.H2与H3互为同位素 |
B.N 离子中含36个电子 离子中含36个电子 |
| C.C60的硬度比金刚石大 |
| D.O2与O4互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| B.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
| C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D.据测定,许多反应的温度每升高10K,其反应速率增加2~4倍。在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。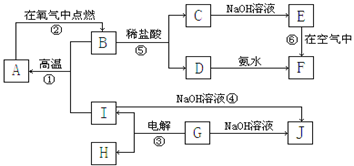
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第 周期、第 族;
(2)写出反应①的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③的电极方程式:
阳极: 阴极:
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是 。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题:
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):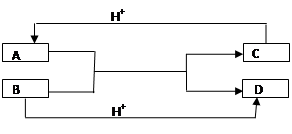
(1) 如果A、B、C、D均是10电子的粒子,请写出A、D的化学式:
A____________ D_______________
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
① A与B在溶液中反应的离子方程式为:___________________________________
② 根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。
图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性气态氧化物 |
| 3 | F的浓溶液常做干燥剂 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲为非电解质。
根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A B 丁 。
(2)元素A在周期表中的位置是 ,写出甲的一种用 途 。
(3)写出下列变化的方程式:
A与NaOH溶液反应的化学方程式 。
乙与过量CO2反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
药用有机物A为一种无色液体,从A出发可发生如下一系列反应:请回答: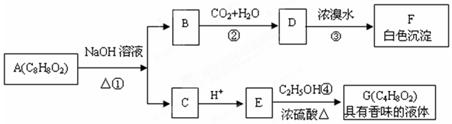
(1)化合物D结构简式: ,化合物E中的官能团名称:___________;
(2)写出反应①的化学方程式: ;
(3)写出反应④的化学方程式: ;
(4)有机物A的同分异体甚多,其中有芳香酸和芳香酯,试各写一种结构简式 _____________;
(5)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应,试写出H的银镜反应方程式:______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com