
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题:
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
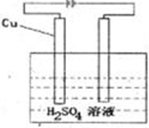
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
(11分)(1)第二周期第ⅣA族;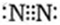 (各1分) (2)HF>H2O>H2S>SiH4(2分)
(各1分) (2)HF>H2O>H2S>SiH4(2分)
(3)SOCl2+H2O=2HC+SO2↑(2分)
(4)半导体材料、制造合金、光电池等合理答案(1分);SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
(5) (2分)
(2分)
解析试题分析:根据元素的主要化合价和原子半径的递变规律可知,元素A~H分别是S、Si、O、P、F、N、C、Cl。
(1)元素G是C元素,在周期中的位置是第二周期第ⅣA族;元素F所形成的常见单质是氮气,其电子式为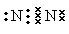 。
。
(2)非金属性越强,氢化物的稳定性越强。同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱, A、B、C、E的非金属性强弱顺序是F>O>S>Si,所以其氢化物稳定性顺序是HF>H2O>H2S>SiH4。
(3)分子组成为ACH2的物质是SOCl2,在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,所以该气体是SO2。根据原子守恒可知,强酸应该是盐酸,所以该反应的化学方程式是SOCl2+H2O=2HC+SO2↑。
(4)硅单质的一种重要用途半导体材料、制造合金、光电池等;工业上制取该单质的原理反应为SiO2+2C Si+2CO↑。
Si+2CO↑。
(5)铜不能和稀硫酸反应生成氢气和硫酸铜,因此要使该反应进行,则应该借助于电解原理。其中铜和电源的正极相连,作阳极,电解质溶液是稀硫酸。氢离子在阴极放电生成氢气,所以该装置图是 。
。
考点:考查元素周期表的结构和元素周期律的应用;单质硅的用途和制备;电解原理的应用等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
化学已经渗透到人类生活的各个方面,下列说法不正确的是
| A.食盐可作氯碱工业的原料 |
| B.碘酒是指单质碘的乙醇溶液 |
| C.大量使用化肥和农药,以提高农作物产量,符合绿色化学的原则 |
| D.低碳生活注重节能减排,尽量使用太阳能灯代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: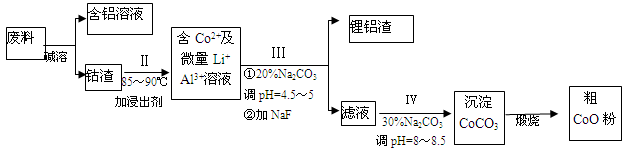
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。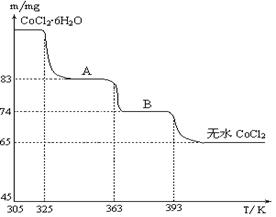
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(10分)下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H是呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。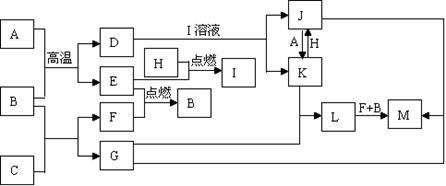
(1)写出H的化学式: 、C的电子式: 。
(2)写出D与I溶液发生反应的离子方程式: 。
(3)写出L→M的化学方程式: 。
(4)检验J中的阳离子时,不宜选用下列试剂中的 (填选项字母)。
A.Fe粉 B.NaOH溶液 C.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。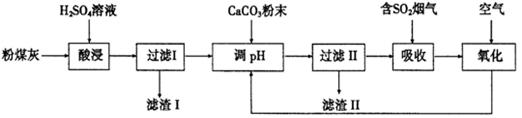
(1)酸浸时反应的化学方程式为 ;滤渣I的主要成分为 (填化学式)。
(2)滤渣Ⅱ的主要成分为 (填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为 。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为 ;氧化后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
下图表示某些化工生产的流程(部分反应条件和产物略去)
(1)反应Ⅰ需在500℃进行,其主要原因是 。
(2)G转化为H的过程中,需要不断补充空气,其原因是 。
(3)写出反应Ⅲ的化学方程式 。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是 (填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
下表为元素周期表的一部分,参照元素①~⑦在表中的位置
请用相关的化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | | | ② | ④ | |
| 3 | ⑤ | | ③ | | | ⑥ | ⑦ | |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
(1)B中含有的官能团的名称是_________________________。
(2)反应①、③的有机反应类型分别是___________________、____________________。
(3)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2mol Ag
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4) 的同分异构体中同时符合下列条件的芳香族化合物共有__________种。
的同分异构体中同时符合下列条件的芳香族化合物共有__________种。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(5)写出反应⑤的化学方程式________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com