
【题目】碳及其含碳化合物在人们的生产生活中应用广泛。
(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),得到如表三组数据;
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO2 | H2 | H2 | C2H5OH | |||
1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
3 | 900 | 4 | 8.8 | C | d | t |
①实验1中以v(H2)表示的反应速率为________________
②已知在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数称之为化学平衡常数。900℃化学平衡常数为______________,
③如果改变影响平衡的条件之一(如温度,压强,反应物的浓度)平衡将向着能够减弱这种改变的方向移动。则第3组与第2组相比CO2的转化率___________(填“增大”“减小”“不变” 不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒). 持续通入甲烷,在标准状况下,消耗甲烷体积VL.
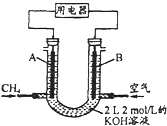
①0<V![]() 44.8L时,负极电极反应为_________________
44.8L时,负极电极反应为_________________
②44.8L<V![]() 89.6L时,电池总反应方程式为_____________
89.6L时,电池总反应方程式为_____________
【答案】 0.4mol/(L.min) 0.12 增大 CH48e+10OH=CO32+7H2O CH4+2O2+K2CO3=2KHCO3+H2O
【解析】(1)①实验1中6min到达平衡,平衡时消耗氢气为(6.8-2)mol=4.8mol,v(H2)=  =0.4mol/(L.min);
=0.4mol/(L.min);
②900℃平衡时氢气为2mol、乙醇为0.4mol,则:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
起始量(mol):2 4.4 0 0
变化量(mol):0.8 2.4 0.4 1.2
平衡量(mol):1.2 2 0.4 1.2
900℃平衡常数K=![]() =0.12;
=0.12;
③第3组等效为第2组平衡的基础上增大压强,平衡正向移动,CO2的转化率增大;
(2)①n(KOH)=2mol/L×1L=2mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得0<n(CO2)≤1mol,二氧化碳不足量,则反应生成碳酸钾,电池总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,负极电极反应为CH48e+10OH=CO32+7H2O;
②根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾,负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,总反应式为CH4+2O2+K2CO3=2KHCO3+H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
B.在加入铝粉能放出氢气的溶液中,K+、NH![]() 、CO
、CO![]() 、Cl-一定能够大量共存
、Cl-一定能够大量共存
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下反应的化学方祝式或离子方程式:
(1)铝与黑色铁的化合物(有磁性)反应_____________。
(2)工业上制粗硅的反应____________。
(3)硫酸铝溶液中加入过量氨水的离子方程式____________。
(4)用稀盐酸清洗铜器皿表面上的铜锈的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业是工农业生产和国防工业的基础产业,也是国民经济的命脉产业。其原理如下:N2(g)+3H2(g)2NH3(g)△H〈 0 。
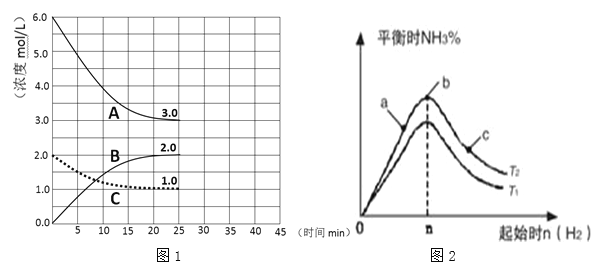
(1)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如图1所示。
① 表示H2浓度变化的曲线是 (填序号)。
② 前25min 内,用NH3浓度变化表示的化学反应速率是 。
(2)某学习小组研究:在其他条件不变的情况下,研究改变起始物氢气的物质的量对该合成氨反应的影响.实验结果如图2所示:(图中T表示温度,n表示物质的量)
①比较T1 T2 (填“>”,“<”, “=”)。
②比较在a、b、c三点N2的转化率最高的是 ;H2的百分含量最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时(用含n的代数式表示),反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则在T2条件下,该反应的平衡常数K= 。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素。甲、乙、丙、丁之间的转化关系如右图所示,则乙不可能是( )

A.Al(OH)3 B.FeCl3
C.CO D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是4种短周期元素,在元素周期表中的位置如下图所示,其中Z位于ⅦA族。下列判断错误的是( )
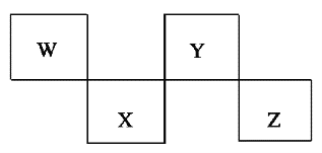
A. 常压下四种元素的单质中,W单质的熔点最高 B. Z的阴离子电子层结构与氩原子的相同
C. W的氢化物的沸点比Y的氢化物的沸点高 D. Y元素的非金属性比X元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com