
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯代物的数目分别是( )[
A.2个甲基,可能生成4种一氯代物
B.3个甲基,可能生成3种一氯代物
C.3个甲基,可能生成5种一氯代物
D.4个甲基,可能生成4种一氯代物
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①是通过O2与C反应实现的,测知生成14gCO时放出60kJ的热量,则其热化学方程式为 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克液态甲醇完全燃料放热25kJ,写出甲醇燃烧生成1molCO2的热化学方程式 。若将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极: 负极:
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H= - 400kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H= - 560kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+140kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―260kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+70kJ·mol―1
则O3转化为O2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废旧锌锰电池处理得到含锰混合物,既能减少它对环境的污染,又能实现废电池的资源化利用。
Ⅰ. 回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
(1)写出MnO(OH)与浓盐酸反应的化学方程式:_________。
Ⅱ. 锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH + MnO2 + 2H2C2O4 + 3H2SO4 == 3MnSO4 + 4CO2↑ + 6H2O
(2)与使用浓盐酸回收锰相比,新方法的优点是_________(答1点即可)。
(3)欲以MnSO4溶液为原料制备MnCO3,选用的加料方式___________(填字母),原因是___________。
已知:Ksp(MnCO3)=2.3×10﹣11、Ksp[Mn(OH)2]=2.1×10﹣13
a. 将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b. 将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c. 将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d. 以上三种方式都无法得到MnCO3.
Ⅲ. 现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
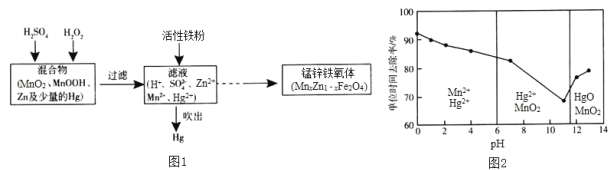
请回答下列问题:
(4)MnxZn1﹣xFe2O4中铁元素化合价为+3,则锰元素的化合价为___________。
(5)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(6)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为__________________。
(7)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如图2所示:
①写出pH=10时KMnO4溶液吸收汞蒸气的离子方程式________________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对乙烯和聚乙烯的描述中,不正确的是( )
A.乙烯是纯净物,聚乙烯是混合物
B.常温下,乙烯为气态,聚乙烯为固态
C.乙烯的化学性质与聚乙烯相同
D.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
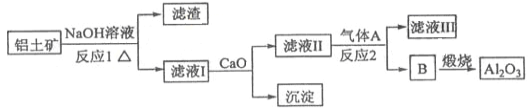
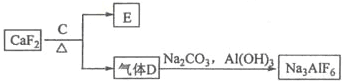
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式__________________________;
(2)滤液Ⅰ中加入CaO生成的沉淀是____________,反应2的离子方程式为____________________;
(3)E可作为建筑材料,化合物C是__________,写出由D制备冰晶石的化学方程式____________;
(4)电解制铝的化学方程式是__________________,以石墨为电极,阳极产生的混合气体的成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别物质的方法错误的是( )
A. 用酚酞鉴别食盐水和稀醋酸
B. 用水鉴别生石灰和石灰石
C. 用燃着的木条鉴别空气和二氧化碳
D. 用氯化钡溶液鉴别稀盐酸和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
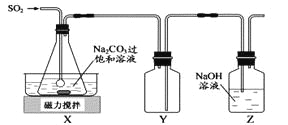
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的氧化产物是甲,还原产物是乙,甲和乙都能与钠反应放出H2,甲和乙反应生成丙,甲和丙都能发生银镜反应。该有机物是
A. 甲醛 B. 乙醛 C. 甲酸 D. 甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机盐在生命活动中不可缺少,合成叶绿素和血红蛋白分子必需的离子分别是( )
A. Mg2+、Fe2+ B. Ca2+、Mg2+
C. PO43-、K+ D. K+、I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com