
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
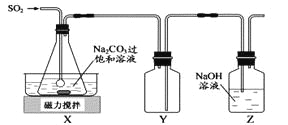
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
【答案】(1)2SO2+CO32-+H2O=2HSO3-+CO2;
(2)防止倒吸;
(3)①吸滤瓶;②减少Na2S2O5在水中的溶解;
(4)在制备过程中Na2S2O5易分解生成Na2SO3,且Na2SO3易被氧化生成Na2SO4。
【解析】试题分析:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,多余的二氧化硫可用氢氧化钠溶液吸收,因二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸。
(1)向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,反应的离子方程式为2SO2+CO32-+H2O=2HSO3-+CO2,故答案为:2SO2+CO32-+H2O=2HSO3-+CO2;
(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,故答案为:防止倒吸;
(3)①组成减压抽滤装置的主要仪器是布氏漏斗、吸滤瓶和抽气泵,故答案为:吸滤瓶;②由反应2NaHSO3═Na2S2O5+H2O可知,增大HSO3-的浓度,有利于生成Na2S2O5,用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,故答案为:减少Na2S2O5在水中的溶解;
(4)Na2S2O5易分解生成Na2SO3,且Na2SO3易被氧化,可知验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,故答案为:在制备过程中Na2S2O5易分解生成Na2SO3,且Na2SO3易被氧化生成Na2SO4。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如右图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
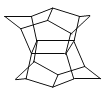
A.分子式为C20H20
B.一氯代物的同分异构体只有两种
C.分子中含有4个亚甲基(—CH2—)
D.分子中含有12个五元碳环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯代物的数目分别是( )[
A.2个甲基,可能生成4种一氯代物
B.3个甲基,可能生成3种一氯代物
C.3个甲基,可能生成5种一氯代物
D.4个甲基,可能生成4种一氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 人的血红蛋白由4条(α、α、β、β)多肽链组成,其中每条α链含氨基酸141个,每条β链含氨基酸146个,则血红蛋白含肽键 ( )
A. 283个 B. 285个 C. 286个 D. 570个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O 3种化学元素在组成人体的化学成分中,质量分数占73%左右,而这3种元素在组成岩石圈的化学成分中,质量分数还不到1%.这个事实说明 ( )
A. 生物界和非生物界具有统一性 B. 生物界和非生物界具有差异性
C. 生物界和非生物界本质相同 D. 生物界具有独特的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
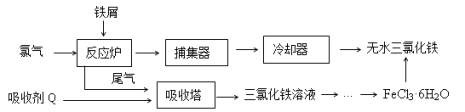
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦核能 ⑧氢能
A. ①②③④ B. ②③⑥⑧
C. ①②⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g) + H2O(g)![]() CO2 + H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
CO2 + H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说不正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com